(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的特性与合成
发布日期:2022/12/21 10:01:39
简介
(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯无法比拟的环保、安全和益于健康的优势,更适合应用于食品、化妆品和保健品等相关领域,但其潜在开发价值不仅限于此。(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯作为色素中间体具有良好的开发前景[1-2]。(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯还可以作为太阳能电池的原料,可以通过昂贵且有毒的钌复合物实现能量的高转化效率,将仿生合成的吡咯烷羧酸苄酯衍生物作为高效替代光敏剂[3]。
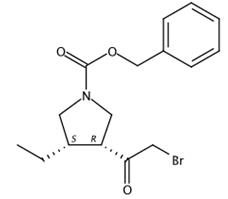
图1 (3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的结构式。
合成
![图2 (3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的合成路线[4]。 图2 (3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的合成路线[4]。](/NewsImg/2022-12-13/6380654906354058533057656.jpg)
图2 (3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的合成路线[4]。
步骤1:(R)-1-(萘-1-基)乙铵(3R,4S)-1-(苄氧基羰基)-4-乙基吡咯烷-3-羧酸盐。在搅拌下向顺式-1-(苄氧基羰基)-4-乙基吡咯烷-3-羧酸(375克,1149毫摩尔)在乙腈(2升)中的溶液中加入(S)-1-(萘-1-基)乙胺(68.9克,402毫摩尔)。15小时后,收集固体并真空干燥,得到(S)-1-(萘-1-基)乙铵(3S,4R)-1-(苄氧基羰基)-4-乙基吡咯烷-3-甲酸酯(64.85克,145毫摩尔,13%)(erg98:2,Rt=5.31分钟,表1,方法g)。将滤液真空浓缩,溶于Et2O(2L)中,并用1N HCl水溶液(2L)和盐水(1L)洗涤。将有机层干燥(MgSO4),过滤并真空浓缩。将油溶于乙腈(2L)中,在搅拌下加入(R)-1-(萘-1-基)乙胺(98g,575mmol)。约15小时后,通过过滤收集固体。将湿固体(350 g)在乙腈(3.5 L)中制浆并加热至约80℃。搅拌。约4小时后,将混合物冷却至约40℃。过滤并真空干燥得到中间体1。
步骤2:将中间体1(25 g,55.7 mmol)加入到含有Et2O(500 mL)和1N HCl水溶液(350 mL)的分液漏斗中。摇动混合物直到所有固体溶解。分离各层,用盐水(200mL)洗涤有机层,干燥(MgSO4),过滤并真空浓缩。将得到的(3R,4S)-1-(苄氧基羰基)-4-乙基吡咯烷-3-羧酸溶解在DCM(200mL)中,加入DMF(0.043mL,0.557mmol),并加入草酰氯(2M在DCM中,55.7mL,111mmol)。停止鼓泡后(约4小时),将反应混合物再搅拌约2小时,然后真空浓缩。将粗酰氯溶解于THF(100 mL)和乙腈(100 mL,冷却至约0至10°C。加入TMS重氮甲烷(1M Et2O,195 mL,195 mmol),同时保持温度低于约10°C。约2小时后,加入48%HBr水溶液(63.1 mL,557 mmol),使内部温度不超过约10°C。约4小时后,用Et2O(300mL)和水(300ml)稀释反应混合物。分离有机层,用饱和NaHCO3水溶液(300mL)和盐水(200mL)洗涤,用MgSO4干燥,过滤并真空浓缩得到标题化合物(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯。产率:(19.5g,99%)。LC/MS(方法a)Rt=2.37分钟;MS m/z:354356(m+H)+。
理化特性
(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯对pH值极其敏感,在不同的pH值下,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的颜色特征会发生很大差异,当水溶液pH值在2以下时,其主要以烊盐离子的形式存在并表现红色,当pH值在弱酸性范围时,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯以无色的甲醇假碱或半缩醛形式存在,水溶液逐渐接近中性时,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯去质子化为醌式碱,还可能开环成查耳酮的形式。查耳酮不稳定,会进一步裂解成酚醛或酚酸[5-7]。pH值继续升高时,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯逐渐变为紫色的中性醌式碱及蓝色的离子化醌式碱。随着pH值的增加,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯在水溶液中的降解速率也会变得越来越大,此外,当pH值上升至5-6,(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的稳定性较酸性条件急剧下降,中性条件下展现出最差的稳定性[8]。
参考文献
[1] C. Liu, T.G.M. Dhar, H.H. Gu, E.J. Iwanowicz, K. Leftheris, W.J. Pitts, T.F. Herpin, Z. Pi, G.S. Bisacchi, Preparation of substituted oxazoles as IMPDH inhibitors, USA . 2002, pp. 41 pp., Cont.-in-part of U.S. Ser. No. 428,432.
[2] X.-L. Li, J. Tian, X.-M. Xu, Y.-J. Hou, Stereoselective synthesis of derivatives of polyhydroxylated pyrrolidines, Gaodeng Xuexiao Huaxue Xuebao 27(4) (2006) 660-665.
[3] B. Wang, J. Lv, W. Xu, Asymmetric synthesis of D-prolinamide, Huagong Jinzhan 24(8) (2005) 897-900.
[4] X.-L. Li, P.-Z. Zhang, J. Tian, K.-F. Duan, H. Chen, A practical and efficient synthesis of five-membered aza sugar derivatives, Youji Huaxue 27(8) (2007) 1013-1017.
[5] V. Aureggi, V. Franckevicius, M.O. Kitching, S.V. Ley, D.A. Longbottom, A.J. Oelke, G. Sedelmeier, (S)-5-pyrrolidin-2-yl-1H-tetrazole, Org. Synth. 85 (2008) 72-87.
[6] Z. Bi, R. Wang, H. Yu, T. Luo, R. Ma, A process for preparing cis-octahydro-pyrrolo[3,2-b]pyrrole and its derivatives, WuXi AppTec Shanghai Co., Ltd., Peop. Rep. China; Shanghai Hequan Pharmaceutical Co., Ltd. . 2011, p. 6pp.
[7] M.-H. Huang, Y.-X. Li, Y.-M. Jia, C.-Y. Yu, General intermediates for the synthesis of 6-C-alkylated DMDP-related natural products, Molecules 18 (2013) 6723-6733.
[8] B. Bernardim, L.D. Lordello, A.C.B. Burtoloso, α,β-Unsaturated Diazoketones as Versatile Building Blocks for the Synthesis of Hydroxylated Piperidines, Indolizidines and Quinolizidines, Curr. Top. Med. Chem. (Sharjah, United Arab Emirates) 13(17) (2013) 2099-2103.a
欢迎您浏览更多关于(3R,4S)-3-(2-溴乙酰基)-4-乙基-1-吡咯烷羧酸苄酯的相关新闻资讯信息