中性蛋白酶的性质与性能
发布日期:2020/10/22 21:04:06
背景及概述【1】
中性蛋白酶是最早用于工业生产的蛋白酶。大多数微生物中性蛋白酶是金属酶,酶蛋白中含有Zn2。,相对分子质量35 000~40 000.等电点(pI)8~9,是微生物蛋白酶中最不稳定的酶,很易自溶,即使在低温冰冻干燥,也会造成相对分子质量的明显减少。代表性的中性蛋白酶是耐热解蛋白芽孢杆菌所产生的热解素与枯草芽孢杆菌(B.subtilis)的中性蛋白酶。这些酶在pH6~7稳定,超出此范嗣迅速失活。以酪蛋白为底物时,枯草芽孢杆菌蛋白酶最适pH为7~8,热解素是pH7~9,曲霉菌的酶是pH6.5~7.5。
一般中性蛋白酶的热稳定性较差.枯草芽孢杆菌中性蛋白酶在pH7、60℃处理15min,失活90%;栖土曲霉(Aspergillus terricola)3.942中性蛋白酶55℃处理10min。失活80%以上;而放线菌166中性蛋白酶的热稳定性更差,只在35。C以下稳定,45℃迅速失活。只有少数例外,如热解素在80。C处理1h,尚存酶活50%;有的枯草芽孢杆菌中性蛋白酶,在pH7、65℃酶活几乎无损失。酶的最适温度取决于反应时间.在反应时间lO~30min内,最适温度45~50℃。钙离子可以增加酶的稳定性,并减少酶自溶,故中性蛋白酶提纯过程的每一步都需有钙离子的存在。
用合成底物实验表明,中性蛋白酶只水解由亮氨酸、苯丙氨酸、酪氨酸等疏水大分子氨基酸提供氨基的肽键。对不同氨基酸构成的肽键的水解能力,因酶的来源而异,大体是亮氨酸>苯丙氨酸>酪氨酸。
工业生产中性蛋白酶常用的碳源是葡萄糖、淀粉、玉米粉、米糠、麸皮等,主要的氮源是豆饼粉、鱼粉、血粉、酵母、玉米浆等。在固体培养栖土曲霉3.942时,麸皮原料中掺加30%~40%废曲或酒糟,酶活可达15 000U/g以上。
性状与性能【2】
细菌蛋白酶粉状制品由淡白色至雁皮色,几乎无臭。细菌蛋白酶主要水解蛋白质及肽,底物的特异性很广泛,水解酪蛋白中的肽键约1/3,明胶的肽键约1/4;也能水解酯键和酰胺键。最适pH为6.5~10,最适温度为30~60℃。
毒性
ADI不作特殊规定(FA()/WHO,2001)。
使用
工业上应用于啤酒生产。采用北京啤酒厂生产的1398细菌蛋白酶(枯草杆菌,中性蛋白酶,酶活力40 000 U/g),其用量为大麦量的0.2%左右。添加细菌蛋白酶,可使大麦汁中的蛋白质分解作用加强,有利于啤酒的风味和提高泡沫非生物稳定性等。另外,本酶可用作面团改良剂、制革、制造蛋白水解物等。
性质【3】
大多数中性蛋白酶是含锌离子的金属酶,相对分子质量为35000~40000,等电点为pH值8~9.是微生物蛋白酶中最不稳定的酶,很易自溶,即使在低温冰冻干燥,也会造成相对分子质量的明显减少。
(一)一般性质
大多数微生物中性蛋白酶是金属酶,一分子酶蛋白中含一原子锌,分子质量35 000-40 000,等电点pH8~9,是微生物蛋白酶中最不稳定的酶,很易自溶,即使在低温冰冻干燥,也会造成分子质量的明显减少。
代表性的中性蛋白酶是耐热解蛋白芽孢杆菌所产生的热解素与枯草杆菌的中性蛋白酶,这些酶在pH6~7稳定,超出此范围迅速失活。以酪蛋白为底物时,枯草杆菌蛋白酶最适pH为7~8,热解素是7~9,曲霉菌的酶是pH 6.5~7.5。
一般中性蛋白酶的热稳定性较差,枯草杆菌中性蛋白酶在pH7,60*(2处理15min,失活90%;栖土曲霉3.942中性蛋白酶55℃处理10min,失活80%以上;而放线菌166中性蛋白酶的热稳定性更差,只在35℃以下稳定,45。C迅速失活。只有少数例外,如热解素在80℃处理1h,尚存酶活50%;有的枯草杆菌中性蛋白酶,在pH7,65℃酶活几乎无损失。酶的最适温度,取决于反应时间,在反应时间lo~30rain内,最适温度是45~50℃。钙离子可以增加酶的稳定性,并减少自溶。
(二)活性中心
酶的活性中心的锌离子,起着酶同底物之间的桥梁作用。
有些酶的分子中尚含若干原子钙(表5—16)。钙具有稳定构象的作用,还同酶的耐拭杜右擎
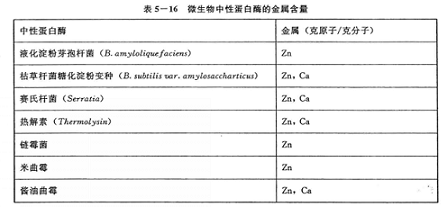
若活性中心的锌用EDTA去除后,用其他金属置换,由不同金属可得到活性不同的酶。借助此法可改进蛋白酶的活性以制备高活性蛋白酶结晶,据认为高活性型的酶其活性中心含有钙、钴、铜、锰、镍和锌原子,如用钡、镉、铁、钠、铅置换,则得到的蛋白酶无活性,结晶的钙型酶,酶活性比普通的结晶高3倍以上。以锰代替多黏芽孢杆菌中性蛋白酶活性中心的锌,酶活提高56%,并提高了耐热性。不少中性蛋白酶的氨基酸组成已经测定。芽孢杆菌中性蛋白酶中,均不含半胱氨酸所构成的二硫键,有的还不含甲硫氨酸。对于氨基酸的顺序尚不清楚。枯草杆菌中性蛋白酶,酶分子中的2~3个酪氨酸和1个组氨酸残基同锌原子一起是表现酶的活性所不可少的,而一个色氨酸和几个钙原子在维持酶的构象上有重要作用。短小芽孢杆菌中性蛋白酶,酶活性的表现除需要锌外,尚需丝氨酸残基。耐热性的中性蛋白酶热解素与枯草杆菌中性蛋白酶A,其活性中心氨基酸是一致的。
(三)专一性
中性蛋白酶的最小合成底物是Z—Gty—X—NH:,其中的X须是疏水性大分子氨基酸,若切开点肽键的羧基是由丙氨酸、丝氨酸、苏氨酸或组氨酸残基所提供,则水解力增强。中性蛋白酶对于碱性蛋白酶的合成底物几乎完全没有作用。
不少芽孢杆菌也生产碱性蛋白酶。可利用羟基磷灰石吸附中性蛋白酶,而同碱性蛋白酶分开。由于中性蛋白酶优先切开亮氨酸或苯丙氨酸构成的肽键,因此可以用呋喃基丙烯酰甘氨基乙酰亮氨酸酰胺(FAGLA,Furyl acryloyl glycyl leucine amide)为底物,用分光光度法作精确的测定。
制备【4】
生产菌种
中性蛋白酶是最早用于工业生产的蛋白酶。不少微生物的中性蛋白酶已经纯化,并对其进行了详细研究。商品中性蛋白酶的生产菌种主要是枯草杆菌、耐热解蛋白芽孢杆菌、寄生曲霉、米曲霉、栖土曲霉、灰色链霉菌等。
1.生产工艺
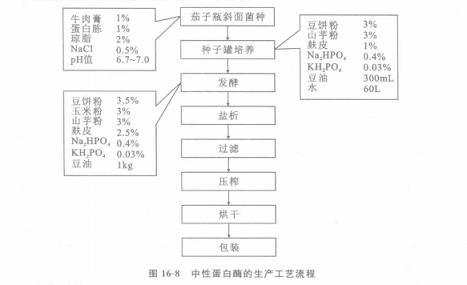
中性蛋白酶的生产工艺流程如图16—8所示。
2.操作要点
(1)菌种选育制好培养基接种后,30。C下培养26h,o~5。C冰箱保存。AS 1.398的变异株AS 1.398—14—1l一14,产酶能力比母株提高19%,且较稳定。
(2)种子罐培养 种子罐内径400mm,高850mm,容积150I。,装料70L,搅拌速度320 r/min。培养基在9800Pa灭菌30min。培养温度29~31℃(低温季节30~32℃),通风积的1/2以下,再加工业硫酸铵至浓度42%,盐析12~16h.除去上清液后,加硅藻土2%,经离心分离或压滤.取出酶泥,绞碾成细条,置真空度9.6×104~9.9×104Pa下,35℃干燥之后.磨粉即为成品。成品酶活力为1 00000U/g左右。总收率约55%,1t发酵液可得到酶粉约l 6kg。
原酶粉常需添加填料,以制得酶活均一的酶制剂。填料应选用不损害酶的活性、不吸湿,又不影响使用的材料。CaCO。、淀粉、乳糖、明胶、硅藻土、Na:SO。、NaCI、MgO、NaHCO。等均是工业上常用的填料。
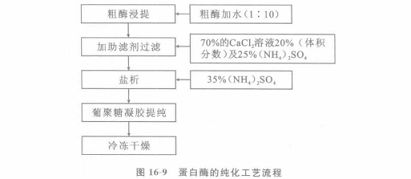
蛋白酶作药用时,需将粗酶纯化.其工艺流程如图16—9所示。操作要点如下:粗酶加水(1:10)浸提,再加浓度为70%的CaC[:溶液20%(体积分数)及25%(NH。):SO。(mg/L)作为净化助滤剂,过滤后得到澄清酶液,再加35%(NH。):SO。盐析酶,过滤收集酶泥溶解于0.02mol/I。pH值为7.2的磷酸盐缓冲液中,通过葡聚糖凝胶G一25脱盐。柱体为lClTI×]0cm,柱中凝胶先用0,02mol/L pH值为7.2的磷酸盐缓冲液平衡,然后在柱顶注酶,通过的酶量为床体积的20%,流毕用0.02mol/L pH值为7.2的磷酸盐缓冲液洗脱,收集无盐酶
液冷冻干燥即可。按此工艺由粗酶到部分纯化酶的收率为50%以上,每克酶的活性提高22倍,达到1200000U/g,酶的比活可提高4倍。粗酶液中的酶蛋白也可在5。C用丙酮沉淀后以70%丙酮反复洗涤脱盐,收率50%左右。将粗酶盐析分段,酶的比活可增加15~20倍。
(5)液体酶的制备 将发酵液过滤后,用刮板薄膜蒸发器在35~40。C、真空度约85000Pa下浓缩3倍后,在酶的稳定pH值(6.5~7.o)T,添加15%NaCI和2%乙醇.置密闭容器内(以减少氧化引起的失活),低温下可保存数月。
参考文献
[1]何国庆主编,食品发酵与酿造工艺学,中国农业出版社,2011.08,第282页
[2]郝利平等主编,食品添加剂 第3版,中国农业大学出版社,2016.07,第246页
[3]郭立泉,王红宇主编;韩丹,曹伟东副主编,酶工程,东北师范大学出版社,2011.05,第183页
[4]刘明华,全永亮主编;尚英,范琳,王大红,孙丽华,肖云副主编,发酵与酿造技术,武汉理工大学出版社,2015.06,第311页
欢迎您浏览更多关于中性蛋白酶的相关新闻资讯信息
