髓鞘少突胶质细胞糖蛋白抗体阳性的视神经脊髓炎谱系疾病的研究进展
发布日期:2020/10/21 8:45:43
视神经脊髓炎(neuromyelitis optica,NMO)也称Devic病,是一种中枢神经系统特发性炎性脱髓鞘疾病,主要特征为单发或反复发作的视神经炎和急性脊髓炎。2004至2005年Lennon等发现NMO-IgG抗体(aquaprorin 4,AQP4抗体)后,提示NMO可能为一种自身免疫性通道病,后续的研究又将NMO扩大为视神经脊髓炎疾病谱(neuromyelitis optica spectrum disorders,NMOSDs)。 NMOSD是指病理机制与NMO相似,但病灶和临床表现不完全符合NMO,包括:(1)长节段横惯性脊髓炎(longitudinally extensive transverse myeliti,LETM) 、复发性双侧视神经炎(bilateral optic neuritis,BON)和孤立性视神经炎(recurrent isolated optic neuritis,RION);(2)NMO伴有器官特异性或非器官特异性自身免疫疾病;(3)伴有颅内病灶的不典型病例;(4)亚洲视神经炎型多发性硬化(opticospinal multiple sclerosis,OSMS)。大约90%NMO患者和50%NMOSD患者AQP4抗体阳性,有部分NMO及NMOSD患者尽管使用了现可用的的检验方法检验患者急性期治疗前样本血清AQP4抗体仍为阴性。
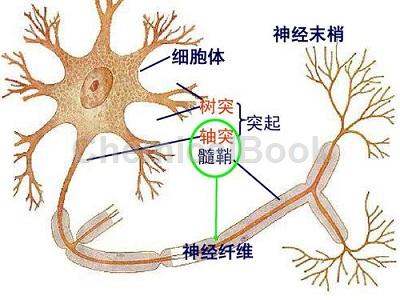
髓鞘少突胶质细胞糖蛋白(myelinoligodendrocyte glycoprotein,MOG)是一种存在于中枢神经系统(central nervous system,CNS)髓鞘最外层含量极微的髓鞘蛋白成分,是免疫球蛋白IgG1的一种亚型,有效的调节补体依赖性细胞毒性反应。最近有报道发现MOG抗体在AQP4抗体阴性的NMOSD患者中表达。一项来自日本和巴西215例NMOSD患者的MOG抗体检测研究,发现在AQP4抗体血清阴性组中MOG抗体阳性率为21.1%。该研究及来自另一个牛津大学的研究表明,均应用cell-based assays(CBA)方法检测,无一例患者血清AQP4抗体和MOG抗体同为阳性。这对视神经脊髓炎机制又提出了一个新的疑问和挑战,血清MOG抗体阳性的NMO患者或许是区别于AQP4抗体阳性患者的另一种独立的疾病实体,只是他们有着相似的临床表现。本文就目前MOG抗体在血清阴性的NMOSD中的流行病学、发病机制、临床表现、影像学特征、生化检查、治疗及预后的研究进展进行综述,为早期临床诊断、鉴别及治疗提供一定的临床基础。
一、 MOG-IgG与视神经脊髓炎谱系疾病
1. 流行病学特点:研究显示MOG阳性组发病更年轻,也有研究显示MOG抗体阳性、阴性和AQP4抗体阳性组三者间,发病年龄无统计学意义。MOG阳性组与AQP4抗体阳性组和双抗体阴性组相比多为男性和高加索人。
2. 临床表现: MOG抗体次通过CBA检测法被Mader等发现存在于AQP4 抗体阴性的NMOSD患者中,随后在相关实验中得到证实。MOG抗体阳性患者任何年龄均可发病,主要表现为复发的视神经炎或长节段横贯性脊髓炎,少部分表现为横贯性脊髓炎或急性播散性脑脊髓炎。特别是MOG抗体和同时发生的双侧视神经炎(BON)有密切关系,这在多发性硬化(multiple sclerosis,MS) 是相对少见的。有些临床表现为同时或相继发生的视神经和脊髓炎,与经典的Devic病相似,这些表现在AQP4抗体阳性的NMO患者中相对少见。MOG抗体阳性的NMOSD较AQP4抗体阳性者更年轻,女性为主导不明显。眼底检查和放射学检查发现MOG抗体阳性者视神经乳头肿胀明显,这个与AQP4抗体阳性和MS相关的视神经炎不同。次表现为LETM的MOG抗体阳性患者较抗体阴性者更容易出现视神经炎的复发。头颅MRI病灶仅在29%的患者中可见,并且他们中大多数无相应临床症状,缺乏MS的特征性卵圆形或垂直于侧脑室的病灶。MOG抗体阳性者脊髓受累较AQP4抗体阳性和双抗体阴性少见,多表现为胸腰髓受累,AQP4抗体阳性及双阴性组病灶多为颈、胸髓受累。在MOG抗体阳性和阴性、AQP4抗体阳性组累积的脊髓长度无明显差异,三者脊髓MRI均显示轴位像上病灶多位于脊髓中央。
3. 辅助检查:(1)脑脊液:细胞数增多主要表现为单核细胞,蛋白升高,但MOG抗体阳性、AQP4抗体阳性及血清抗体阴性患者脑脊液细胞数及蛋白差别无统计学意义。有报道显示,AQP4抗体阴性但MOG抗体阳性者,脑脊液中胶质纤维酸性蛋白水平正常或偏低但髓鞘碱性蛋白明显增高,缺乏寡克隆带寡克隆区带的产生,这暗示与MS不同。
(2)血清AQP4抗体阴性的NMOSD患者中部分患者血清可检测到MOG-IgG,其阳性率较低,急性期抗体滴度增高,经过激素及免疫制剂治疗后滴度降低。MOG阳性患者血沉较快。自身抗核抗体(ANA)在MOG抗体阳性患者中较少见,其他与AQP4抗体阳性组和双阴性组无明显差异。
(3) 影像学检查:MOG抗体阳性患者视神经MRI显示双侧视神经受累长度广泛,尤其是前视觉通路,伴有前部视神经肿胀和眼球后视神经常被累及。头颅 MRI大多表现正常,部分患者可出现较大脱髓鞘病灶直径>3cm,多位于白质、内囊、延髓被盖,有些患者还表现为可逆性后部脑白质病变,脊髓MRI表现为炎性脱髓鞘病灶,连续长度一般≥3个椎体节段,轴位像病灶多位于脊髓中央,病灶主要见于胸段、腰段可累及脊髓圆锥,而AQP4抗体阳性者更多表现为颈胸段脊髓受累。一些患者经过激素治疗后,影像学显示脑部病灶迅速减少。光学相关断层扫描(optical coherence tomography,OCT)检查发现MOG抗体阳性者视神经肿胀明显,但与AQP4抗体阳性者相比视网膜神经元丢失较少。
4. 治疗及转归:多数患者诊断符合2015年NMOSD国际共识,MOG抗体阳性对激素及血浆置换效果明显,尽管在激素撤退或停止时存在迅速复发的倾向,提示在某些患者必须给予免疫抑制药物控制。部分患者经过治疗血清抗体持续阳性。然而,在部分患者使用吗替麦考酚酯等免疫抑制剂治疗可以诱导临床和放射学病灶缓解,维持血清抗体阴性。目前治疗主要根据NMO的治疗方案,急性期给予大剂量甲泼尼龙冲击疗法,从1g/d 开始,静脉滴注,共5d,剂量阶梯递减,后改为口服长期治疗,或血浆置换疗法,一般置换3-5次,每次用血浆2-3L。缓解期治疗:主要通过抑制免疫达到降低复发率,延缓残疾累积的目的,给予硫唑嘌呤联合泼尼松或者利妥昔单抗、吗替麦考酚酯、环磷酰胺治疗。然而一些用于MS的治疗,如干扰素、那他株单抗、芬戈莫德在AQP4抗体阳性时可使病情恶化,但他们在MOG抗体相关性疾病中的作用并不清楚。对于MOG抗体阳性者目前缺乏大型的前瞻性病例对照研究制定的治疗方案。但AQP4-IgG阳性NMO的潜在新治疗方法,如西维来司他(抑制中性粒细胞浸润)或者依库珠单抗(抑制补体)可能对MOG-IgG阳性的NMO患者作用不大, 因为MOG抗体对补体激活作用较小。
研究显示MOG阳性抗体NMOSD总体预后较好,与AQP4抗体的NMOSD患者相比更多表现为单向病程,多表现为视神经炎的复发,最后随访扩展残疾状态评分量表(EDSS)评分较AQP4抗体阳性者低,有研究显示MOG抗体阳性者可向AQP4抗体转化,也有报道如果不能早期识别及恰当治疗,MOG-IgG阳性者仍有可能出现严重的视力丧失、视网膜神经纤维层萎缩或者残疾。即便MOG抗体阳性者经过多次复发或者两者次发作时严重程度相似,但MOG抗体阳性的LETM患者EDSS评分仍较抗体阴性者低,其原因可能是:EDSS评分主要侧重于运动功能,MOG抗体阳性患者很多仅表现为视神经炎,尽管严重视力残疾,EDSS评分也不会很高。目前,还没有相关报道MOG-IgG阳性与疾病进展或严重程度的关系,需要进一步前瞻性研究证实。
二、可能发病机制
目前有较多证据可证明AQP4抗体在NMOSD中的发病机制,但缺乏MOG抗体在 NMOSD中的发病机制;根据动物实验研究,MOG抗体引起中枢神经系统损伤的可能病理机制被证实。
MOG抗体阳性的儿童显示MOG免疫球蛋白诱导自然杀伤细胞介导的细胞毒作用减少MOG的表达,同时显示出抗体滴度相关性的抗体依赖的细胞介导的细胞毒性作用。把MOG抗体用在动物体外或体内研究中提示存在补体介导的脱髓鞘。大多数的MOG抗体是免疫球蛋白IgG1的一种亚型,可能用来固定补体及结合FC受体,Mader等证实来自MOG抗体阳性患者的高滴度MOG在体外通过MOG转染细胞可以激活补体级联反应并诱导细胞裂解,然而低滴度的MOG抗体和MOG抗体阴性的患者没有上述作用,进一步证实补体介导的细胞毒作用。此外,来自MOG抗体阳性患者的纯化的MOG免疫球蛋白仅导致组织的精细结构丢失和少突胶质细胞的微管细胞骨架的重建,但不增加细胞坏死。
将MOG抗体注射到小鼠的大脑内导致髓鞘和轴索损害,改变轴索蛋白的表达,这些改变是非补体依赖性的并在2周内是可逆的,无炎性细胞浸润,不引起轴索脱失、神经元或星形胶质细胞坏死,而AQP4-IgG则是补体介导的髓鞘丢失,炎性细胞浸润、神经元及星形胶质细胞坏死在2周内不能完全恢复,暗示两种抗体可能介导不同的机制。Zhou等发现在体外MOG抗体可诱导表达MOG靶细胞的坏死,同时发现高滴度MOG抗体的血清转入实验性自身免疫性脑脊髓炎动物模型的小鼠体内增加髓鞘脱失。鉴于人类MOG抗体很大程度上不能结合小鼠的MOG,很难对上述结果作出解释。
虽然对MOG抗体导致髓鞘脱失的病理机制有初步证据,但还需要进一步研究解决现有的不足。小鼠和人类MOG的抗原表位存在差异,需要进一步的体内研究阐述MOG抗体在NMOSD中的发病机制。
三、MOG-IgG检测方法
1. CBA:用增强型荧光标记的人全长MOGCDNA转染人胚肾293(HEK293)细胞,转染24h后,HEK293转染细胞和患者血清在37℃条件下孵化30min,用 4%的甲醛溶液固定10min和0.3%的Triton X-100浸泡,用Alexa Fluor594标记的山羊抗人IgG标记HEKcells,通过流式细胞术和间接免疫荧光法分析HEK293 转染细胞。该方法敏感度和特异度均较高,未发现双阳性报道,且MOG-IgG阳性者具有相似的表现型。
2. 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA):将已知的抗原或抗体吸附在固相载体表面,使酶标记的抗原抗体反应在固相表面进行。2014年Hoftberger等用该方法检测174例患者血清发现2例两种抗体均为阳性,且MOG-IgG和AQP4抗体阳性者临床表现与AQP4抗体阳性者相似。该方法采用线性的MOG蛋白碎片,很可能导致非特异性抗体的吸附,降低实验特异度。
目前对于是否存在双抗体阳性仍存在争议,即使敏感度高的CBA法检测仍有部分双抗体阴性,分析原因:(1)血清中存在AQP4-IgG或者MOG-IgG,但现有检测方法不敏感,无法检测出;(2)血清中可能存在其他抗体,有待进一步研究发现;(3)对于检测出双抗体阳性,可能是检测方法特异度低,使用高敏感度、高特异度的检测法或者多种检测法综合评估;(4)血清中不存在抗体,可能是非抗体介导的异质性疾病。
四、展望
近期研究发现AQP4抗体阴性的NMOSD患者血清中存在较高比例的MOG-IgG,并且该部分患者临床表现、影像学、脑脊液及预后与AQP4抗体有明显不同,总体上认为该部分患者大多为单相病程并且预后较好,部分研究认为MOG-IgG可能介导一种不同于MS或NMO的中枢神经系统脱髓鞘病,这需要大量研究探讨MOG-IgG在脱髓鞘病中的发病机制,为了能更好地诊断、治疗AQP4抗体阴性的NMOSD,需要一个公认的AQP4抗体阴性的NMOSD患者MOG抗体标准化诊断,以便以后更好地诊断 AQP4抗体阴性患者,鉴别其他脱髓鞘疾病,并给予有效治疗,减少残疾发生率。
欢迎您浏览更多关于髓鞘少突胶质细胞糖蛋白的相关新闻资讯信息