-
外観
無色澄明の液体
-
性質
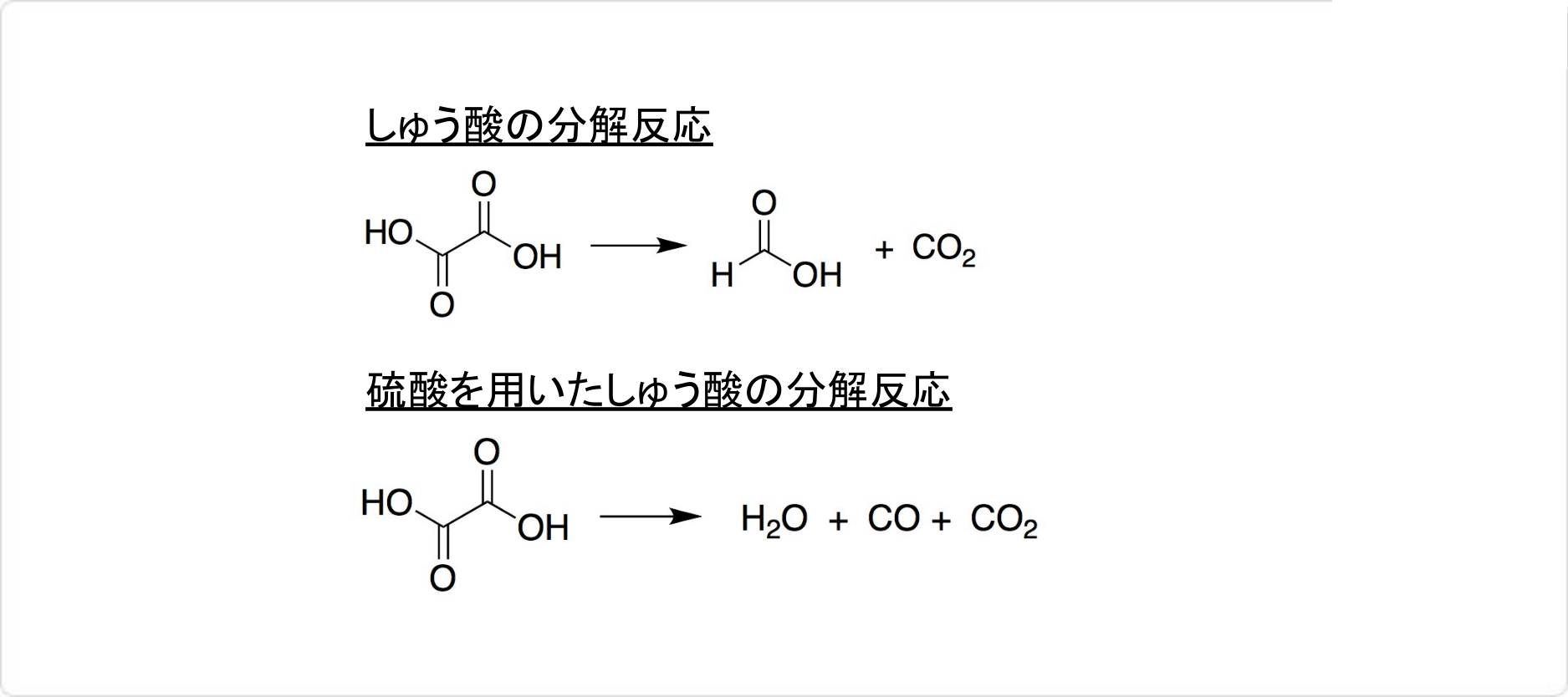
図2. しゅう酸の反応
しゅう酸は、冷水やに非常に溶解して、熱水にもよく溶けます。エーテルなどの有機溶媒には溶けにくいです。カルボン酸としては、非常に酸性が強い物質です。
水溶液中でカルボキシ基が電離して、2価の酸として働きます。弱酸として分類される場合が多いですが、などよりも強い酸です。0.1 mol/dm3の水溶液では、第一段階の電離度が0.6程度と大きいです。
しゅう酸の無水物は加熱すると189.5℃で分解して、一酸化炭素・・を生成します。硫酸の混合といった条件の工夫によって、生じたギ酸が分解されて、水と一酸化炭素を放出します。
しゅう酸は吸湿性がある化合物です。湿気を含む空気中に放置すると二水和物が生成し、水溶液でも二水和物が析出します。五酸化二リンを加えたデシケーター中に入れるか、100℃に加熱することで、しゅう酸の二水和物は結晶水を失って、無水物に変わります。
-
溶解性
水及びエタノールと任意の割合で混和する。
-
解説
シュウ酸,無水和物は無色、無臭の吸湿性結晶.融点189.5 ℃(分解).高温で加熱すると分解してギ酸,一酸化炭素,および二酸化炭素を生じる.d174 1.900.K1 5.36×10-2,K2 5.3×10-5.水,エタノールに可溶,エーテルに難溶.硫酸酸性の過マンガン酸カリウム水溶液を還元脱色する.空気中で容易に二水和物C2H2O4?2H2Oにかわる.二水和物は無色の板状またはプリズム状結晶.融点101.5 ℃.d18.54 1.653.昇華性がある.注意して100 ℃ で乾燥すると無水和物にかわる.二水和物は酸,塩基および過マンガン酸塩滴定における標準物質として分析用に用いるほか,化学薬品,染料製造や漂白剤の原料として多方面に用いられる.
森北出版「化学辞典(第2版)
-
用途
酸化性物質の定量(過マンガン酸カリウム溶液と併用)
-
用途
有機合成原料、漂白剤。
-
用途
ブドウ糖等の製造、染料用
-
用途
微量成分の酸化還元容量分析。
-
用途
水アメ?ブドウ糖の製造(加水分解用),分析用試薬,希土類精製,有機合成原料 (NITE CHRIP)
-
存在
シュウ酸,植物界に広く存在し,とくにカタバミOxalisの葉には,シュウ酸の水素カリウム塩C2O4KHとして,また種々の植物細胞液中には,そのカリウムあるいはカルシウム塩として含まれている.多くのかび類の代謝産物でもある.
-
構造
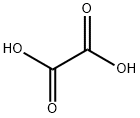
ジカルボン酸としては、最も簡単な構造の化合物です。構造式はHOOC–COOHで表されます。
しゅう酸の第一段階解離で生じるしゅう酸水素イオン (H(COO)2−) は、1価の陰イオンです。第二段階解離によって、2価の陰イオンであるしゅう酸イオン ((COO)22-) が生成します。
しゅう酸イオンは平面型を取っていて、炭素-炭素間は単結合です。炭素-酸素間は共鳴しており、単結合および二重結合の中間的な性質を有します。
-
製造
セルロース,たとえばおがくずのNaOHによる融解あるいはHNO3による酸化によって生成するが,今日では一酸化炭素を濃いNaOH水溶液に吸収させてギ酸ナトリウムをつくり,それをカルシウム塩にかえて硫酸で分解してシュウ酸をつくっている.
-
化学的特性
Oxalic acid is a colorless, odorless powder, or
granular solid. The anhydrous form (COOH)2 is an odorless,
white solid; the solution is a colorless liquid.
-
物理的性質
Colorless and odorless rhombic crystals. Hygroscopic. soluble in ethanol, soluble in water, slightly soluble in ether, insoluble in benzene and chloroform.
-
使用
Oxalic acid was used:
· in the synthesis of hemicellulose hydrolysates of yellow poplars;
· in the synthesis of three-dimensionally ordered macroporous metal oxides or carbonates via templating with polystyrene spheres;
· as supporting electrolyte in the electrochemical synthesis of polyaniline-polypyrrole composite coatings.
-
定義
ChEBI: Oxalic acid is an alpha,omega-dicarboxylic acid that is ethane substituted by carboxyl groups at positions 1 and 2. It has a role as a human metabolite, a plant metabolite and an algal metabolite. It is a conjugate acid of an oxalate(1-) and an oxalate.
-
調製方法
Many industrial processes have been employed for the manufacture of oxalic acid since it was first synthesized. The following processes are in use worldwide: oxidation of carbohydrates, the ethylene glycol process, the propylene process, the dialkyl oxalate process, and the sodium formate process. Sodium formate process is no longer economical in the leading industrial countries, except for China.
Nitric acid oxidation is used where carbohydrates, ethylene glycol, and propylene are the starting materials. The dialkyl oxalate process is the newest, where dialkyl oxalate is synthesized from carbon monoxide and alcohol, then hydrolyzed to oxalic acid. This process has been developed by UBE Industries in Japan.Many attempts have been made to synthesize oxalic acid by electrochemical reduction of carbon dioxide in either aqueous or nonaqueous electrolytes.
-
反応性
The reactions of oxalic acid, including the formation of normal and acid salts and esters, are typical of the dicarboxylic acids class. Oxalic acid, however, does not form an anhydride.
On rapid heating, oxalic acid decomposes to formic acid, carbon monoxide, carbon dioxide, and water. In aqueous solution, it is decomposed by uv, x-ray, or γ -radiation with the liberation of carbon dioxide. Photodecomposition also occurs in the presence of uranyl salts.
Oxalic acid is a mild reducing agent, and is oxidized by potassium permanganate in acid solution to give carbon dioxide and water. Oxalic acid is catalytically reduced by hydrogen in the presence of ruthenium catalyst to ethylene glycol, and electronically reduced to glyoxylic acid.
Oxalic acid reacts with various metals to form metal salts, which are quite important as the derivatives of oxalic acid. It also reacts easily with alcohols to give esters.
-
一般的な説明
Odorless white solid. Sinks and mixes with water.
-
空気と水の反応
Water soluble. Hygroscopic
-
反応プロフィール
Oxalic acid is hygroscopic and sensitive to heat. Oxalic acid may react violently with furfuryl alcohol, silver, sodium, perchlorate, sodium hypochlorite, strong oxidizers, sodium chlorite, acid chlorides, metals and alkali metals. . The heating of mixtures of Oxalic acid and urea has lead to explosions. This is due to the rapid generation of the gases, CO2, CO, and NH3, [Praxis Naturwiss. Chem., 1987, 36(8), 41-42]. Oxalic acid and urea react at high temperatures to form toxic and flammable ammonia and carbon monoxide gasses, and inert CO2 gas [Von Bentzinger, R. et al., Praxis Naturwiss. Chem., 1987, 36(8), 41-42].
-
健康ハザード
As dust or as a solution, can cause severe burns of eyes, skin, or mucous membranes. Ingestion of 5 grams has caused death with symptoms of nausea, shock, collapse, and convulsions coming on rapidly. Repeated or prolonged skin exposure can cause dermatitis and slow-healing ulcers.
-
火災危険
Special Hazards of Combustion Products: Generates poisonous gases
-
使用用途
しゅう酸は、染料の原料、麦藁・木綿などの漂白剤、各種化学薬品の原料として、多方面に用いられています。
1. 食品分野
食品分野では、水飴ぶどう糖の製造や植物油の精製などに利用可能です。
2. 医療分野
医薬品分野では、持続性サルファ剤やしゅう酸セリウム、アミノ酸製剤、α-ケト酸等の製造に用いられています。
3. 金属処理分野
それに加えて金属処理の分野でも、幅広く利用可能です。具体例として、化学研磨やピックリング (酸洗浄) 、車両・船舶洗浄、ラジエーター洗浄 (除錆・脱スケール効果) 、の冷間引抜用潤滑剤、製造、稀土類の精製などが挙げられます。
しゅう酸から純粋な二水和物の結晶が得られることを利用し、酸アルカリ滴定および酸化還元滴定の標準物質としても使用されています。
-
その他の情報
1. しゅう酸イオンを含む化合物
しゅう酸イオンを含んだイオン結晶であるしゅう酸塩 (英: oxalate) と、しゅう酸水素イオンを含んだ酸性塩であるしゅう酸水素塩 (英: hydrogenoxalate) が存在します。
アルカリ金属塩、アルミニウム塩、アンモニウム塩、鉄 (III) 塩などのしゅう酸塩は水に可溶性です。アルカリ土類金属塩を代表とする、多くのしゅう酸塩が難溶性です。また、鉄 (III) 塩の水溶液は徐々に分解してしゅう酸鉄 (II) (FeC2O4) を析出し、銀塩は加熱によって爆発的に分解します。
2. 自然界におけるしゅう酸
しゅう酸は植物に多く含まれています。漢字では「蓚酸」と書き、「蓚酸」とはタデ科のスイバのことです。具体的には、タデ科、カタバミ科、アカザ科などの植物に、しゅう酸水素ナトリウムのような水溶性しゅう酸塩が含まれています。
その一方でサトイモ科の植物には、などの不溶性しゅう酸塩が含まれています。ヤマノイモ科の植物の根菜で作られたとろろが、肌に付いて痒みを感じるのは、しゅう酸カルシウムの針状結晶が肌に刺さり刺激を受けるからです。
参考文献
-
农业用途
Oxalic acid, (COOH)2, also called ethanedioic acid, is a
white, crystalline solid, slightly soluble in water. It is a
naturally occurring highly oxidized organic compound with significant chelating activity. It is strongly acidic
and poisonous, produced by many plants like sorrel
(sourwood), the leaf blades of rhubarb, bark of
eucalyptus and many plant roots. In plant cells and
tissues, oxalic acid gets accumulated as either sodium,
potassium or calcium oxalate, of which the latter occurs
as crystals. In turn, salts of oxalic acids enter the bodies
of animals and human beings, causing pathological
disorders, depending upon the amount consumed. Many
species of fungi like Aspergillus, Penicillium, Mucor, as
well as some lichens and slime moulds produce calcium
oxalate crystals. Upon the death of these microorganisms,
plants and animals, the salts get released into
the soil, causing some amount of toxicity. However,
oxalate-degrading microbes, called Oxalobacter
formigenes, decrease oxalate absorption in animals and
humans.
Oxalic acid is the first of a series of dicarboxylic
acids. It is used (a) as a bleaching agent for stains like rust
or ink, (b) in textile and leather production, and (c) as
monoglyceryl oxalate in the production of ally1 alcohol
and formic acid.
-
職業ばく露
Oxalic acid is used in textile finishing,
paint stripping; metal and equipment cleaning; as an intermediate;
as an analytic reagent and in the manufacture of
dyes, inks, bleaches, and paint removers; varnishes, wood,
and metal cleansers; dextrin, cream of tartar, celluloid, oxalates,
tartaric acid, purified methyl alcohol, glycerol, and
stable hydrogen cyanide. It is also used in the photographic,
ceramic, metallurgic, rubber, leather, engraving, pharmaceutical,
paper, and lithographic industries.
-
環境運命予測
Biological. Heukelekian and Rand (1955) reported a 5-d BOD value of 0.12 g/g which is 66.7%
of the ThOD value of 0.18 g/g.
Chemical/Physical. At temperatures greater than 189.5 °C, decomposes to carbon dioxide,
carbon monoxide, formic acid, and water (Windholz et al., 1983). Ozonolysis of oxalic acid in
distilled water at 25 °C under acidic conditions (pH 6.3) yielded carbon dioxide (Kuo et al., 1977).
Absorbs moisture in air forming the dihydrate (Huntress and Mulliken, 1941).
Reacts with bases forming water soluble salts.
-
輸送方法
UN3261 Corrosive solid, acidic, organic, n.o.s.,
Hazard class: 8; Labels: 8-Corrosive material, Technical
Name Required.
-
不和合性
The aqueous solution is a medium-strong
acid. Compounds of the carboxyl group react with all bases,
both inorganic and organic (i.e., amines) releasing substantial
heat, water and a salt that may be harmful. Incompatible with
arsenic compounds (releases hydrogen cyanide gas), diazo
compounds, dithiocarbamates, isocyanates, mercaptans,
nitrides, and sulfides (releasing heat, toxic, and possibly flammable
gases), thiosulfates and dithionites (releasing hydrogen
sulfate and oxides of sulfur). Incompatible with oxidizers
(chlorates, nitrates, peroxides, permanganates, perchlorates,
chlorine, bromine, fluorine, etc.); contact may cause fires or
explosions. Keep away from silver compounds; strong alkalis;
chlorites. Contact with some silver compounds forms explosive
materials.
-
廃棄物の処理
Pretreatment involves chemical
reaction with limestone or calcium oxide forming calcium
oxalate. This may then be incinerated utilizing
particulate collection equipment to collect calcium oxide
for recycling.