人肠静脉组织提取物的应用
发布日期:2020/10/18 17:56:53
背景[1-4]
人肠静脉组织提取物分离自人肠静脉组织,可以直接用于基因克隆,表达图谱分析以及各种分子生物学实验的研究。肠静脉是肝门静脉的主要属支,分为肠系膜上静脉和肠系膜下静脉。前者主要收集小肠血液,后者主要收集大肠血液在胰脏附近注入脾静脉,然后脾静脉和肠系膜上静脉汇合成肝门静脉,行于肝十二指肠韧带中入肝门。
肠系膜上静脉,走行于小肠系膜内,其发生症变为肠系膜上静脉血栓,治疗方法多为切除。肠系膜上静脉(superior mesenteric vein):走行于小肠系膜内,与同名动脉伴行。收集十二指肠至结肠左曲以上肠管、部分胃和胰腺的静脉血,并与脾静脉一起构成门静脉。肠系膜下静脉主要是收集肠道内的静脉血液内含有营养比较高,但是还有的血氧浓度相对比较低。这种情况往往。血液进入肝脏,经过肝脏处理,然后进入心脏,营养全身的组织。如果出现病变,有可能导致血液循环比较差,导致营养比较差的情况。需要积极的考虑手术或者是抗凝药物治疗。
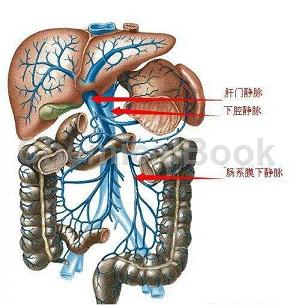
门静脉起源于腹腔消化器官(消化管和胰)、脾等的毛细血管,经逐级汇集最后形成门静脉,是肝脏血液的主要来源(约占70%)。门静脉入肝后再反复分支最后汇入肝血窦,因此是介于两端毛细血管间的静脉系。门静脉在肝十二指肠韧带处,位于肝动脉和胆总管后方。在肝十二指肠韧带游离缘,一般没有门静脉的属支。在十二指肠部后方,有来自胃、胰十二指肠的静脉直接注入门静脉。在肝门的位置,门静脉分为粗短的右干和细长的左干,门静脉左干和右干分别发出1-3条小静脉至尾状叶至左右段,有部分病人的右前叶门静脉也直接从门静脉主干发出,或来自门静脉左干的横部。
门静脉在胰颈后方约相当于第二腰椎高度,下腔静脉的前方,由肠系膜上静脉和脾静脉以直角汇成。肠系膜下静脉汇入脾静脉者占52.02%;肠系膜下静脉汇入肠系膜上静脉者占24.60%;或由脾静脉,肠系膜上、下静脉共同汇成门静脉,占13.29%。
应用[5][6]
人肠静脉组织提取物可用于GC-C信号通路在溃疡性结肠炎肠道屏障及炎症发生中的作用:
溃疡性结肠炎(ulcerativecolitis,UC)是一种主要累及结肠的慢性特发性肠道炎症性疾病,是炎症性肠病(inflammatory bowel disease,IBD)的主要类型,以反复发作的腹痛、腹泻和粘液脓血便为常见临床症状。由于其病程迁延反复和结肠癌高风险率而严重影响患者生活质量,耗费大量医疗资源。
近年来研究发现鸟苷酸环化酶C(guanylate cyclase C,GC-C)信号转导通路调节肠上皮屏障功能和肠道炎症的发生。GC-C是一种主要表达于肠上皮细胞的跨膜受体,鸟苷蛋白(guanylin,Gn)和尿鸟苷素(uroguanylin,Ugn)是其内源性配体,亦表达于胃肠道上皮细胞。热稳定性肠毒素(heat-stable enterotoxin,STa)是GC-C的外源性配体,由产肠毒素大肠杆菌产生。
当这些配体(Gn/Ugn/STa)与GC-C结合后细胞内环磷酸鸟苷(cyclic guanosine monophosphate cGMP)水平增高,激活GC-C信号通路,参与调节细胞内外正常的离子浓度和肠道水电解质平衡。UC患者结肠粘膜组织中GC-C及其内源性配体Gn和Ugn的表达量与健康对照人群相比均明显降低,且随着UC患者疾病活动度增加,GC-C、Gn和Ugn的表达下降更为显著。提示UC患者GC-C信号通路活性降低,其活性与UC疾病活动度呈负相关。GC-C信号通路可能参与了UC的发生与发展。
在上述发现的基础上,为了进一步说明GC-C信号通路在肠道屏障及炎症损伤中的作用,我们运用人肠上皮细胞Caco-2单层屏障模型进行实验研究,通过检测GC-C信号通路关键因子(GC-C、Gn、Ugn和cGMP)、TJPs(occludin、claudin-1和ZO-1)和促炎症因子(IL-8和TNF-α)的表达,发现细胞在白介素1β(Interleukin-1β,IL-1β)刺激下GC-C、Gn、Ugn、cGMP、claudin-1和ZO-1的表达明显降低,细胞活力和超氧化物歧化酶(superoxidedismutase,SOD)酶活性下降,IL-8和TNF-α的表达明显升高。
经转染Gn过表达载体后,细胞活力、SOD酶活性、Gn、GC-C、cGMP、claudin-1和ZO-1的表达均明显升高,单层细胞的通透性、IL-8和TNF-α的表达明显降低。而经转染GC-CshRNA干扰载体的细胞在IL-1β的刺激下,细胞活力、SOD酶活性、claudin-1和ZO-1的水平下降更明显,单层细胞的通透性、IL-8和TNF-α水平升高更为显著。提示GC-C配体可激活处于静止状态的GC-C信号通路,活化的GC-C信号通路可减轻Caco-2细胞在IL-1β诱导下的屏障功能受损及炎症性损伤。
参考文献
[1]Gastroparesis:Approach,Diagnostic Evaluation,and Management[J].Derek M.Tang,Frank K.Friedenberg.Disease-a-Month.2011(2)
[2]A functional role for the‘fibroblast‐like cells’in gastrointestinal smooth muscles[J].MasaakiKurahashi,HaifengZheng,LauraDwyer,Sean M.Ward,SangDon Koh,Kenton M.Sanders.The Journal of Physiology.2011(3)
[3]Neuroeffector apparatus in gastrointestinal smooth muscle organs[J].Kenton M.Sanders,Sung JinHwang,Sean M.Ward.The Journal of Physiology.2010(23)
[4]Distribution and possible role of PDGF-AA and PDGFR-αin the gastrointestinal tract of adult guinea pigs[J].Fangxiao Chan,Yong Liu,Haimei Sun,Xiaoshuang Li,Hongwei Shang,Dongying Fan,Jing An,Deshan Zhou.Virchows Archiv.2010(3)
[5]Endogenous IGF-I andαVβ3 Integrin Ligands Regulate Increased Smooth Muscle Hyperplasia in Stricturing Crohn’s Disease[J].Robert S.Flynn,Karnam S.Murthy,John R.Grider,John M.Kellum,John F.Kuemmerle.Gastroenterology.2010(1)
[6]兰丹凤.GC-C信号通路在溃疡性结肠炎肠道屏障及炎症发生中的作用[D].昆明医科大学,2017.
欢迎您浏览更多关于人肠静脉组织提取物的相关新闻资讯信息
