AH109感受态细胞的应用
发布日期:2020/10/18 17:56:53
背景[1-6]
AH109感受态细胞来源于PJ69-2A酵母菌株,将lacZ报告基因引入PJ69-2A诞生了AH109,此菌株是Clontech公司开发的GAL4系统酵母双杂实验用菌株,MATa型,可直接转化质粒或与MATα型酵母菌株Y187通过mating操作进行蛋白互作验证或筛库试验。
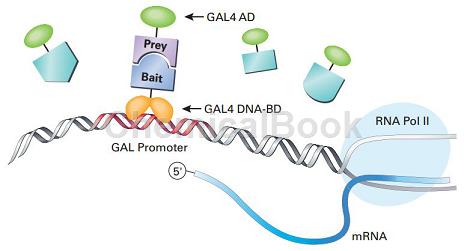
Transformation marker为:trp1,leu2,报告基因为:lacZ,HIS3,ADE2,MEL1。AH109-GAL4酵母双杂系统需要两种质粒配套使用:pGBKT7和pGADT7。质粒pGBKT7的筛选标志为TRP1,用于表达DNA-BD(来自酵母转录因子GAL4N端1~174位氨基酸)与目标蛋白(Bait)的融合蛋白;质粒pGADT7的筛选标志为LEU,用于表达AD(GAL4 C端768~881位氨基酸)与目标蛋白(Prey)的融合蛋白。
GAL4系统原理:一个完整的酵母转录因子GAL4可分为功能上相互独立的两个结构域:位于N端1~174位氨基酸区段的DNA结合域(DNA-BD)和位于C端768~881位氨基酸区段的转录激活域(AD)。DNA-BD能够识别GAL4-responsive gene的上游激活序列UAS,并与之结合。而AD可以启动UAS下游的基因进行转录。BD和AD单独存在不能激活转录,但当二者接近时,则呈现完整的GAL4活性,使含有UAS的启动子下游基因转录表达。正常条件下,BD不与AD结合,将要检测的蛋白质分别与BD和AD融合,形成bait融合蛋白(bait–BD)和prey融合蛋白(prey-AD),如果bait和prey发生相互作用,就会促使BD和AD的相互接近,形成完整的GAL4,从而激活报告基因的转录。
AH109有四个报告基因:lacZ,HIS3,ADE2,MEL1,分别由三种不同的启动子(GAL1,GAL2,MEL1)启动,这三种启动子只有GAL4识别的17 bp核心区相同,其余部分均不同,大大降低了酵母双杂假阳性发生的概率。AH109是酿酒酵母菌株,属于真核细胞。一般的针对原核生物的抗生素例如卡那和氨苄对酵母是无效的,因此为了防止大肠杆菌等原核生物对酵母培养菌株污染,往往会在培养基中加入一些氨苄和卡那霉素的抗生素,来抑制细菌菌的污染和生长。
AH109感受态细胞操作方法:
1.取100μl冰上融化的AH109感受态细胞,依次加入预冷的目的质粒2-5μg,Carrier DNA(95-100度5 min,快速冰浴,重复一次)10μl,PEG/LiAc 500μl并吸打几次混匀,30度水浴30 min(15 min时翻转6-8次混匀)。
2.将管放42℃水浴15 min(7.5 min时翻转6-8次混匀)。
3.5000 rpm离心40 s弃上清,ddH2O 400μl重悬,离心30s弃上清。
4.ddH2O 50μl重悬,涂板,29℃培养48-96 h。酿酒酵母适宜的生长温度是28-30度,一般使用30度培养,温度超过32度可能导致细胞的死亡。
AH109酿酒酵母主要用于酵母双杂交系统,与Y187菌株一起配套使用,用于研究蛋白与蛋白之间的相互作用。AH109酿酒酵母来源于PJ69-2A菌株,含有ADE2和HIS3筛选标记(James et al.,1996).MEL1是一个内源性的GAL4响应基因。lacZ报告基因被导入进入PJ69-2A,从而构建成了AH109(A.Holtz,unpublished).菌株中的His3,ADE2和MEL1/LacZ报告基因是分别有三个完整的GAL4型响应启动子元件--GAL1,GAL2和MEL1进行启动翻译的。
应用[7][8]
AH109感受态细胞可用于STAT4、STAT6与CBP相互作用及其关键结构域的检测:
构建STAT4、STAT6的酵母表达质粒和CBP的诱饵表达质粒,并检测诱饵蛋白的毒性、渗漏和自激活作用,为酵母双杂交检测STAT4、STAT6与CBP的相互作用做准备。方法:PCR扩增小鼠的STAT4、STAT6和CBP基因,分别克隆入酵母双杂交系统的AD和BD载体,测序正确后,将上述质粒分别转化酵母AH109细胞,提取细胞蛋白,western blot检测蛋白表达情况,同时检测诱饵蛋白CBP的毒性、渗漏和自激活作用。
结果:成功扩增了小鼠的STAT4、STAT6和CBP基因,并分别正确克隆入AD和BD载体,测序结果符合要求,western blot证实上述蛋白均能在AH109中正确表达,诱饵蛋白CBP对酵母AH109细胞无毒性和渗漏作用,但检测到自激活作用。
结论:成功构建了用于检测STAT4、STAT6与CBP相互作用的酵母双杂交系统,但检测到诱饵蛋白CBP有自激活作用。第二部分诱饵蛋白CBP自激活结构域的检测目的:将CBP蛋白的各主要结构域分别构建到诱饵表达载体pGBKT7上,分别检测其毒性、渗漏和自激活作用来明确CBP蛋白分子中起自激活作用的关键结构域。酵母双杂交检测STAT4、STAT6与CBP各主要结构域间的相互作用目的:酵母双杂交检测STAT4、STAT6与CBP各主要结构域(TAZ1结构域除外)间的相互作用。
方法:将酵母表达质粒pGADT7-STAT4/6分别与pGBKT7-CBP529-1200、pGBKT7-CBP967-1574和pGBKT7-CBP1678-2175共转化酵母AH109细胞,铺相应营养缺陷的培养板,通过报告基因表达检测筛选阳性克隆。
参考文献
[1]Asthma: epidemiology, etiology and risk factors[J] . Subbarao, Padmaja,Mandhane, Piush J,Sears, Malcolm R. Canadian Medical Association. Journal . 2009 (9)
[2]Oncogenic mechanisms in myeloproliferative disorders[J] . F. Delhommeau,D. F. Pisani,C. James,N. Casadevall,S. Constantinescu,W. Vainchenker. Cellular and Molecular Life Sciences . 2007 (24)
[3]Signaling mechanisms, interaction partners, and target genes of STAT6[J] . Daniel Hebenstreit,Gerald Wirnsberger,Jutta Horejs-Hoeck,Albert Duschl. Cytokine and Growth Factor Reviews . 2006 (3)
[4]Human Tyk2 Kinase Deficiency: Another Primary Immunodeficiency Syndrome[J] . Wendy T. Watford,John J. O’Shea. Immunity . 2006 (5)
[5]JAK-STAT pathway in cardiac ischemic stress[J] . Radha Ananthakrishnan,Kellie Hallam,Qing Li,Ravichandran Ramasamy. Vascular Pharmacology . 2005 (5)
[6]Cytokine Signaling in 2002[J] . John J O’Shea,Massimo Gadina,Robert D Schreiber. Cell . 2002 (2)
[7]Signaling through the JAK/STAT pathway, recent advances and future challenges[J] . T Kisseleva,S Bhattacharya,J Braunstein,C.W Schindler. Gene . 2002 (1)
[8]张明香. STAT4、STAT6与CBP相互作用及其关键结构域的检测[D].重庆医科大学,2010.
欢迎您浏览更多关于AH109感受态细胞的相关新闻资讯信息
