LBA4404 Electro感受态细胞的应用
发布日期:2020/3/19 8:29:39
背景[1-6]
LBA4404 Electro感受态细胞是以Ach5型背景,核基因中含有筛选标签——利福平抗性基因rif,为了便于转化操作,此菌株携带一无自身转运功能的章鱼碱型Ti质粒pAL4404,此质粒含有vir基因(vir基因是T-DNA插入植物基因组必需的元件,pAL4404质粒自身的T-DNA转移功能被破坏,但可以帮助转入的双元载体T-DNA顺利转移)。
pAL4404型Ti质粒含有筛选标签:strep,赋予LBA4404菌株链霉素抗性,适用于菸草、番茄、烟草等植物的转基因操作。唯地生物开发的LBA4404电转感受态特别适用于大质粒的转化:经pCAMBIA2301质粒(size:11633 bp)检测转化效率>105 cfu/μg DNA;经pCAMBIA2301-ZH质粒(size:40 kd)检测转化效率可达103 cfu/μg DNA。
培养方法
1.0.1 cm电击杯和杯盖从储存液中拿出倒置于干净的吸水纸上5分钟,待其沥干水分,正置5分钟,使乙醇充分挥发,待乙醇挥发干净立即插入冰中,压实冰面,电极杯顶离冰面0.5 cm以方便盖上杯盖,冰中静置5分钟充分降温。
2.取-80℃保存的农杆菌感受态插入冰中5分钟,待其融化,加入0.01-1μg质粒DNA(体积不大于6ul,感受态转化效率较高,次使用前做预实验确定所加质粒的量),用手拨打管底混匀,立即插入冰中,用200μl枪头将感受态-质粒混合物快速移到电击杯中,盖上杯盖,空管保留待用。
3.启动电转仪,设置参数:C=25μF,PC=200 ohm,V=2400 V(此参数为Biorad推荐,使用者也可按所用电转仪推荐的protocol操作),将电击杯快速放入电转槽中,电击完成快速插入冰中,加入700μl无抗生素的LB并转移到感受态空管中,28℃振荡培养2~3小时。
4. 6000 rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素的LB或YEB平板上,倒置放于28℃培养箱培养2-3天(当平板只含有50μg/ml kan时,28℃培养48 h即可;平板中同时加入50μg/ml kan,20μg/ml rif时,需28℃培养60 h;如果使用的平板含有50μg/ml rif则需要28℃培养72-90 h)。
注意事项:
1.感受态细胞在冰上融化。
2.混入质粒时应轻柔操作。
3.转化高浓度的质粒可相应减少最终用于涂板的菌量。
5. 4. 利福平浓度不应高于25 μg/ml,过高的利福平浓度不利于农杆菌生长,会降低其生长速度和转化效率。
6. 培养基中加入利福平的目的是防止杂菌生长、筛选农杆菌;根据所用菌株抗性加入Ti质粒筛选抗生素可防止Ti质粒丢失,但Ti质粒筛选抗生素不利于农杆菌的转基因操作。
应用[7-9]
LBA4404 Electro感受态细胞可用于微紫青霉菌菌株GXCR遗传转化体系的建立:
从基因水平来研究丝状真菌与重金属间的相互作用具有重要的意义,近年来发展的根癌农杆菌介导的遗传转化(ATMT)与传统的遗传转化方法相比较,ATMT具有高效、稳定、高频单拷贝随机插入、适用范围广等优点,是目前研究丝状真菌遗传转化的主要手段之一。基于本实验室工作曾分离得到一株高抗多种重金属盐并对苯菌灵敏感的微紫青霉菌(Penicillium janthinellum)菌株GXCR的良好基础,研究将建立由根癌农杆菌LBA4404介导的GXCR菌株的遗传转化体系,为从基因水平上研究该菌株对重金属盐抗性的可能机制提供基础。
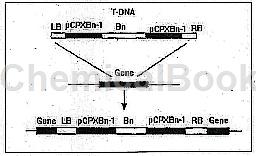
本研究在质粒pGSA1252基础上构建了T-DNA区含有苯菌灵抗性基因(Benomylresistance)的双元载体pG-Bn,通过三亲转化法导入到根癌农杆菌LBA4404中,与稀释至107个/ml的GXCR孢子共培养两天后筛选得到具有苯菌灵抗性的转化株367株,对随机挑取的40株转化株总DNA进行PCR验证,有98%的转化株均能扩增出目的片段,转化效率达到了3.7个转化株/10个小菌块。
随机挑选30个能扩增出目的片段的转化株中,有13个转化株不能在CuSO4 PDA平板上生长,9个转化株的生长明显受CuSO4抑制。同时对表型明显发生变化的转化株总DNA进行Southern杂交分析,结果显示62.5%的转化株为T-DNA单拷贝整合插入,易于利用插入突变来分析相关基因的功能,为对微紫青霉菌菌株GXCR的抗重金属遗传机制的研究提供了宝贵的材料。
参考文献
[1]Gene disruption in Cryptococcus neoformans and Cryptococcus gattii by in vitro transposition[J].Guanggan Hu,James W.Kronstad.Current Genetics.2006(5)
[2]Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Caroline B.Michielse,Paul J.J.Hooykaas,Cees A.M.J.J.Hondel,Arthur F.J.Ram.Current Genetics.2005(1)
[3]Use of REMI and Agrobacterium-mediated transformation to identify pathogenicity mutants of the biocontrol fungus,Coniothyrium minitans[J].Christopher W.Rogers,Michael P.Challen,Jonathan R.Green,John M.Whipps.FEMS Microbiology Letters.2004(2)
[4]Agrobacterium tumefaciens-mediated transformation as a tool for random mutagenesis of Colletotrichum trifolii[J].Hiroyuki Takahara,Gento Tsuji,Yasuyuki Kubo,Mikihiro Yamamoto,Kazuhiro Toyoda,Yoshishige Inagaki,Yuki Ichinose,Tomonori Shiraishi.Journal of General Plant Pathology.2004(2)
[5]Negative selection using thymidine kinase increases the efficiency of recovery of transformants with targeted genes in the filamentous fungus Leptosphaeria maculans[J].Donald M.Gardiner,Barbara J.Howlett.Current Genetics.2004(4)
[6]Agrobacterium-mediated insertional mutagenesis(AIM)of the entomopathogenic fungus Beauveria bassiana[J].Andreas Leclerque,Hong Wan,Anette Abschütz,Siwei Chen,Galina V.Mitina,Gisbert Zimmermann,Hans Ulrich Schairer.Current Genetics.2004(2)
[7]Cloning and targeted disruption,via Agrobacterium tumefaciens-mediated transformation,of a trypsin protease gene from the vascular wilt fungus Verticillium dahliae[J].Katherine F.Dobinson,Sandra J.Grant,Seogchan Kang.Current Genetics.2004(2)
[8]Gene disruption in Trichoderma atroviride via Agrobacterium-mediated transformation[J].Susanne Zeilinger.Current Genetics.2004(1)
[9]玉荣.根癌农杆菌LBA4404介导的微紫青霉菌菌株GXCR遗传转化体系的建立[D].广西大学,2008.
欢迎您浏览更多关于LBA4404 ELECTRO感受态细胞的相关新闻资讯信息