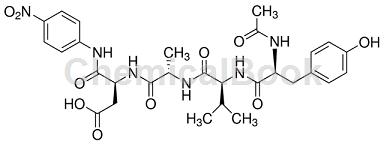
Ac-LEVD-pNA(Caspase 4显色底物)
发布日期:2020/2/12 8:19:56
背景[1-7]
Ac-LEVD-pNA(Caspase 4显色底物)可以用于检测Caspase 4的活性Caspase 4显色底物。Caspase 4可以催化底物Ac-LEVD-pNA产生黄色的pNA(p-nitroaniline),从而可以通过测定吸光度来检测Caspase 4的活性。pNA在405nm附近有强吸收。Caspase(Cysteine-requiring Aspartate Protease)是一个在细胞凋亡过程中起重要作用的蛋白酶家族。Caspase 4有时被写作caspase-4或caspase 4,可以和Apaf-1相互作用并参与细胞色素c导致的caspase 3激活。Caspase 4也可以和caspase 14相互作用。
caspase 4是一种在天冬氨酸残基(LEVD-)上蛋白水解切割其他蛋白质的酶,属于称为半胱天冬酶的半胱氨酸蛋白酶家族。胱天蛋白酶4的功能尚不完全清楚,但它被认为是炎症性半胱天冬酶,以及半胱天冬酶1,半胱天冬酶5(和鼠同源半胱天冬酶11),在免疫系统中起作用。Caspase 4可以和Apaf-1相互作用并参与细胞色素C导致的Caspase 3激活。Caspase 4也可以和caspase 14相互作用。
人类中的Caspase-4和-5以及小鼠中的Caspase-11具有作为受体的独特作用,其与LPS结合,LPS是革兰氏阴性细菌中丰富的分子。这可以通过激活Caspase-1导致IL-1β和IL-18细胞因子的加工和分泌;该下游效果与上述相同。它还导致另一种未加工的炎性细胞因子的分泌。这被称为pro-IL1α。还有证据表明炎症性caspase,caspase-11辅助细胞因子分泌;这是通过灭活阻断IL-1β分泌的膜通道来完成的。细胞凋亡作为一种生命体的主要细胞死亡方式,在清除多余或受感染细胞中发挥重要作用。
尽管在组织或胚胎正常发育过程中,细胞凋亡诱导免疫反应比较温和,但在病毒感染或者对死亡受体(death receptor,DR)进行刺激时凋亡可以触发强烈的天然和获得性免疫反应。凋亡信号途径中的分子与免疫系统有着复杂的相互作用。在脊椎动物中,胱天蛋白酶家族成员,如胱天蛋白酶-1、胱天蛋白酶-4、胱天蛋白酶-5、胱天蛋白酶-11和胱天蛋白酶-12等,可通过蛋白质水解处理前体炎症细胞因子,引起炎症介导子IL-1b和IL-18释放,从而介导炎症反应。胱天蛋白酶-1和胱天蛋白酶-11对促炎症因子IL-1b和IL-18的成熟和释放是必须的。
研究显示,当用脂多糖(LPS)和TNF刺激胱天蛋白酶-1和胱天蛋白酶-11缺陷型小鼠时,其并不发生炎症反应。Shigella flexner诱导炎症或者诱导巨噬细胞凋亡都是通过胱天蛋白酶-1激活IL-1b和IL18来实现的。当Shigella flexner感染casp-1-/-鼠时不会出现急性炎症特征甚至不能够响应细菌的感染。这些结果表明胱天蛋白酶-1在急性炎症中非常重要,同时也表明了胱天蛋白酶-1的底物IL-1b和IL18在炎症反应中是不可或缺的。激活的IL-1b和IL18可以进一步上调肿瘤坏死因子,Fas配体等重要。胱天蛋白酶-4主要被干扰素激活,涉及细菌诱导的细胞死亡。
应用[7-9]
Ac-LEVD-pNA(Caspase 4显色底物)可用于Caspase 4检测试剂盒的生产:
Caspase 4检测试剂盒是基于底物Ac-LEVD-pNA(acetyl-Leu-Glu-Val-Asp p-nitroanilide)的Caspase 4分光光度法检测试剂盒,可用于检测细胞或组织裂解液中Caspase 4活性或纯化的Caspase4活性。Caspase 4活性检测试剂盒是基于caspase 4可以催化底物Ac-LEVD-pNA(acetyl-Leu-Glu-Val-
Asp p-nitroanilide)产生黄色的pNA(p-nitroaniline),从而可以通过测定吸光度来检测caspase 4的活性。pNA在405nm附近有强吸收。主要应用①细胞核、染色体以及基因表达的研究;②生物膜与细胞器的研究;③细胞骨架体系的研究;④细胞增殖及其调控;⑤细胞分化及其调控;⑥细胞的衰老与编程性死亡(凋亡);⑦细胞的起源与进化;⑧细胞工程。
参考文献
[1] Koenig,Ulrich;Eckhart,Leopold;Tschachler,Erwin(2001)."Evidence That Caspase-13 Is Not a Human but a Bovine Gene".Biochemical and Biophysical Research Communications.285(5):1150–4.
[2] Denecker,Geertrui;Ovaere,Petra;Vandenabeele,Peter;Declercq,Wim(2008-02-11)."Caspase-14 reveals its secrets".The Journal of Cell Biology.180(3):451–458.
[3] Shi,Yigong(2004-06-25)."Caspase Activation".Cell.117(7):855–858.
[4] Lahm,Armin;Paradisi,Andrea;Green,Douglas R;Melino,Gerry(2003)."Death fold domain interaction in apoptosis".Cell Death and Differentiation.10(1):10–2.
[5] Kumar,S(2006)."Caspase function in programmed cell death".Cell Death and Differentiation.14(1):32–43.
[6] Riedl,Stefan J.;Shi,Yigong(Nov 2004)."Molecular mechanisms of caspase regulation during apoptosis".Nature Reviews Molecular Cell Biology.5(11):897–907.
[7] Lavrik,I.;Krueger,A.;Schmitz,I.;Baumann,S.;Weyd,H.;Krammer,P.H.;Kirchhoff,S.(2003-01-01)."The active caspase-8 heterotetramer is formed at the CD95 DISC".Cell Death&Differentiation.10(1):144–145.
[8] Elmore,Susan(2007-06-01)."Apoptosis:A Review of Programmed Cell Death".Toxicologic Pathology.35(4):495–516.
[9] Sollberger,Gabriel;Strittmatter,Gerhard E.;Garstkiewicz,Martha;Sand,Jennifer;Beer,Hans-Dietmar(2014-02-01)."Caspase-1:The inflammasome and beyond".Innate Immunity.20(2):115–125.
欢迎您浏览更多关于AC-LEVD-PNA (CASPASE 4显色底物)的相关新闻资讯信息
