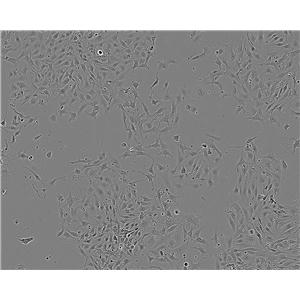
NCI-H125细胞系|人非小细胞肺癌细胞的应用
发布日期:2023/11/10 8:33:13
背景[1-3]
NCI-H125细胞系|人非小细胞肺癌细胞是一种来源于人类非小细胞肺癌的贴壁细胞系。这些细胞具有贴壁生长的特点,即它们能够在培养皿或培养瓶中附着在固体表面上生长。
NCI-H125细胞系|人非小细胞肺癌细胞已经被广泛应用于癌症研究中,特别是在肺癌的研究中。这些细胞系可以用于体外实验,以评估不同药物、治疗方法和基因对癌细胞的影响。此外,它们还可以用于研究肿瘤发生和发展的机制,以及寻找新的治疗靶点。
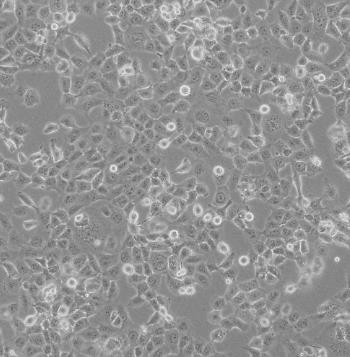
NCI-H125细胞系|人非小细胞肺癌细胞
一.NCI-H125细胞系|人非小细胞肺癌细胞培养基及培养冻存条件准备:
1)准备1640(推荐YJ-0002)培养基;优质胎牛血清,10%;双抗,1%。
2)培养条件:气相:空气,95%;二氧化碳,5%。温度:37℃,培养箱湿度为70%-80%。
3)冻存液:90%血清,10%DMSO,现用现配。
二.NCI-H125细胞系|人非小细胞肺癌细胞细胞处理:
1)冻存细胞的复苏:
将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入到含4-6mL完全培养基的离心管中混合均匀。在1000RPM条件下离心3-5min,弃去上清液,完全培养基重悬细胞。然后将细胞悬液加入含6-8ml完全培养基的培养瓶(或皿)中37℃培养过夜。第二天显微镜下观察细胞生长情况和细胞密度。
2)细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
对于贴壁细胞传代可以参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加入0.25%(w/v)胰蛋白酶-0.53 mM EDTA于培养瓶中(T25瓶1-2mL,T75瓶2-3mL),置于37℃培养箱中消化1-2分钟(难消化的细胞可以适当延长消化时间),然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加入3-4ml含10%FBS的培养基来终止消化。
3.轻轻打匀后吸出,在1000RPM条件下离心3-5min,弃去上清液,补加1-2mL培养液后吹匀。将细胞悬液按1:2的比例分到新T25瓶中,添加6-8ml按照说明书要求配置的新的完全培养基以保持细胞的生长活力,后续传代根据实际情况按1:2~1:5的比例进行。
3)NCI-H125细胞系|人非小细胞肺癌细胞细胞冻存:收到细胞后建议在培养前3代时冻存一批细胞种子以备后续实验使用。
1.细胞冻存时按照细胞传代的过程收集消化好的细胞到离心管中,可使用血球计数板计数,来决定细胞的冻存密度。一般细胞的推荐冻存密度为1×106~1×107个活细胞/ml.
2.1000rpm离心3-5min,去掉上清。用配制好的细胞冻存液重悬细胞,按每1ml冻存液含1×106~1×107个活细胞/ml分配到一个冻存管中将细胞分配到冻存管中,标注好名称、代数、日期等信息。
3.将要冻存的细胞置于程序降温盒中,-80度冰箱中过夜,之后转入液氮容器中储存。同时记录好冻存管在液氮容器中的位置以便后续查阅和使用。
应用[4-5]
NCI-H125细胞系|人非小细胞肺癌细胞可以用于CFTR氯离子通道对肺癌细胞增殖、迁移的影响及机制
本研究中,利用qPCR、Western Blot、免疫细胞化学实验方法,比较CFTR在人正常支气管上皮细胞HBE、人支气管上皮细胞BEAS-2B、人支气管肺泡腺癌细胞NCI-H1650、人肺泡Ⅱ型腺癌细胞A549、人肺鳞癌细胞NCI-H226、NCI-H125细胞系|人非小细胞肺癌细胞、人KRAS突变Ⅲ级表皮样肺癌细胞Calu-1中表达量的区别。利用免疫荧光实验方法,研究CFTR在肺癌细胞中的定位。
利用三种CFTR抑制剂(CFTRinh-172、GlyH-101、BPO-27)和激活剂(Genistein、Forskolin、IBMX)作为工具药,通过细胞增殖、细胞凋亡、细胞划痕、细胞侵袭、Western Blot实验,研究CFTR的氯离子通道功能对上述不同类型的肺癌增殖、凋亡、迁移、侵袭的影响及作用机制。
主要研究结果如下:1.qPCR、Western Blot和免疫细胞化学实验结果显示,CFTR在以下几种细胞中的表达量从高到低依次为HBE、H1650、A549、Calu-1、NCI-H125细胞系|人非小细胞肺癌细胞、BEAS-2B。其中,CFTR在HBE中的表达量远高于人支气管上皮细胞BEAS-2B。CFTR在肺癌细胞中的表达量高于人支气管上皮细胞BEAS-2B。CFTR在肺腺癌细胞H1650和A549中的表达量高于肺鳞癌细胞H226。CFTR在支气管肺泡腺癌细胞H1650中的表达量高于肺泡Ⅱ型腺癌细胞A549。CFTR在KRAS突变的肺癌细胞Calu-1中的表达量低于未发生突变的肺腺癌细胞H1650和A549。
2. 免疫荧光实验结果显示,CFTR定位于肺癌细胞的细胞膜和细胞质,在细胞质中的定位较多。
3.细胞毒性实验结果显示,CFTRinh-172的浓度小于100μM时,对H1650和NCI-H125细胞系|人非小细胞肺癌细胞无毒性;小于50μM时,对A549和Calu-1无毒性。GlyH-101的浓度小于50μM时,对Calu-1无毒性;小于25μM时,对H1650、A549和H226无毒性。BPO-27的浓度小于25 n M时,对H1650、Calu-1和H226无毒性;小于20 n M时,对A549无毒性。Genistein的浓度小于100μM时,对H1650和Calu-1无毒性;小于50μM时,对A549和H226无毒性。IBMX的浓度小于100μM时,对Calu-1无毒性;小于50μM时,对H1650、A549和H226无毒性。Forskolin的浓度小于100μM时,对H1650、A549、Calu-1和H226都无毒性。
4.细胞增殖实验结果显示,CFTR抑制剂CFTRinh-172、GlyH-101和BPO-27能够促进H1650、A549、Calu-1、NCI-H125细胞系|人非小细胞肺癌细胞的增殖。在H1650中,CFTRinh-172的最佳浓度为12.5μM,BPO-27的最佳浓度为12.5 n M。在A549中,CFTRinh-172的最佳浓度为3.125μM,GlyH-101的最佳浓度为1.5625μM,BPO-27的最佳浓度为6.25 n M。在Calu-1中,GlyH-101的最佳浓度为3.125μM,BPO-27的最佳浓度为3.125 n M。在H226中,CFTRinh-172的最佳浓度为12.5μM,GlyH-101的最佳浓度为1.5625μM,BPO-27的最佳浓度为12.5 n M。
参考文献
[1]Cystic fibrosis:a gastrointestinal cancer syndrome.Mordechai Slae;;Michael Wilschanski.The Lancet Oncology,2018
[2]Cftr Modulates Wnt/β-Catenin Signaling and Stem Cell Proliferation in Murine Intestine.Ashlee M.Strubberg;;Jinghua Liu;;Nancy M.Walker;;Casey D.Stefanski;;R.John MacLeod;;Scott T.Magness;;Lane L.Clarke.Cellular and Molecular Gastroenterology and Hepat,2018
[3]Cancer Risk in Patients With Cystic Fibrosis.Antonio Ponzetto.Gastroenterology,2018
[4]Forskolin improves sensitivity to doxorubicin of triple negative breast cancer cells via Protein Kinase A-mediated ERK1/2 inhibition.Michela Illiano;;Luigi Sapio;;Alessia Salzillo;;Lucia Capasso;;Ilaria Caiafa;;Emilio Chiosi;;Annamaria Spina;;Silvio Naviglio.Biochemical Pharmacology,2018
[5]高晓誉.CFTR氯离子通道对肺癌细胞增殖、迁移的影响及机制[D].辽宁师范大学,2021.
欢迎您浏览更多关于NCI-H125细胞系|人非小细胞肺癌细胞的相关新闻资讯信息