兔主动脉平滑肌细胞的应用
发布日期:2023/8/25 15:34:13
背景[1-3]
兔主动脉平滑肌细胞分离自主动脉组织,是一种常用的细胞模型,用于研究动脉粥样硬化。它们通常在培养皿中培养,使用DMEM高糖培养基、10%胎牛血清和1%双抗。
兔主动脉平滑肌细胞采用胰蛋白酶-胶原酶联合消化法结合差速贴壁法制备而来,兔主动脉平滑肌细胞分离自主动脉组织;主动脉是体循环的动脉主干。
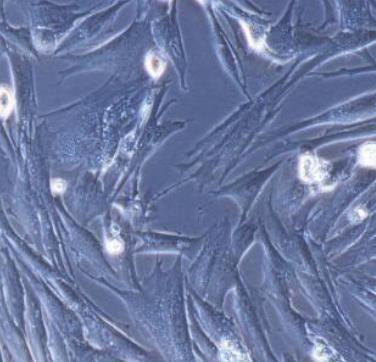
兔主动脉平滑肌细胞
其运行路径为:升主动脉起于左心室,至右侧第2胸肋关节高度移行为主动脉弓,弓行向左后至第4胸椎体下缘移行为降主动脉;在第12胸椎体高度穿膈的主动脉裂孔移行为腹主动脉,以上为胸主动脉,至第4腰椎体下缘分为左、右髂总动脉;髂总动脉在骶髂关节高度分为髂内、外动脉。主动脉平滑肌细胞原代分离培养3天后,可见细胞贴壁伸展,细胞形态大小不一,呈梭形、不规则形、三角形或扇形,核卵圆形、居中;2周后细胞汇合,多数细胞伸展呈长梭形,胞浆丰富,有分枝状突起,细胞平行排列成单层或部分区域多层重叠生长,高低起伏;
细胞密度低时,常交织成网状;密度高时,则排列为旋涡状或栅栏状。传代后细胞生长较快,4-6天即可汇合,并保持上述形态学特征和生长特点。
主动脉平滑肌细胞在心血管疾病发生、发展中具有重要作用,以主动脉平滑肌细胞为实验研究对象,探讨心血管疾病相关发病机制是目前研究的热点;体外培养的主动脉平滑肌细胞对于研究其生理功能、药物作用以及各种致病因素作用下的病理生理改变具重要意义。
应用[4][5]
兔主动脉平滑肌细胞可以用于钙感受器STIM1参与主动脉平滑肌细胞衰老的作用机制研究
在氧化应激诱导的衰老VSMCs模型及自然衰老的动物模型中,观察STIM1是否参与主动脉平滑肌细胞衰老进程,及其相关作用机制。
方法:使用200μM过氧化氢溶液(H2O2)处理人主动脉平滑肌细胞(Human aorta vascular smooth muscle cells,HA-VSMCs)2h构建氧化应激衰老VSMCs模型;C57BL/6分别饲养至3月龄、12月龄、18月龄,建立自然衰老动物模型;Cre-lox P基因重组技术构建平滑肌特异性STIM1敲除小鼠(smc STIM1-/-)模型;采用衰老相关β-半乳糖苷酶染色检测衰老VSMCs阳性率;Western blot检测细胞或组织中钙池操纵性钙通道(store-operated calcium channel,SOC)相关蛋白STIM1、STIM2、ORAI1表达水平、衰老相关标记蛋白蛋白p53、p21、p16及自噬相关蛋白p62、LC3B等表达水平;激光共聚焦测钙技术检测单个细胞的SOCE的钙信号变化,微血管张力测定技术检测收缩剂诱导的及SOC介导的血管收缩功能;转录组高通量测序技术检测STIM1敲除对主动脉平滑肌转录水平的变化。透视电镜检测STIM1敲除对小鼠主动脉平滑肌超微结构的影响;m RFP-GFP-LC3串联荧光蛋白系统检测细胞自噬流变化;流式细胞仪检测细胞内活性氧(reactive oxygen species,ROS)水平。
结果:(1)在H2O2诱导的衰老VSMCs模型上,衰老相关蛋白p21、p16表达上调,衰老相关β-半乳糖苷酶染色阳性细胞率增加,伴STIM1及ORAI1蛋白表达下调,SOCE水平降低;
(2) 老龄小鼠(12月龄、18月龄)主动脉组织SOC相关蛋白STIM1和ORAI1表达下调,以及SOC通道介导的血管收缩反应下降;
(3) smc STIM1-/-小鼠主动脉组织中STIM1水平下降,而STIM2及ORAI1蛋白表达无明显差异,SOC介导的收缩反应几乎消失,不同浓度的Phe诱导的血管收缩无明显差异,然而在硝苯地平预处理后,有或无细胞外钙条件下血管收缩几乎完全消失;
(4) smc STIM1-/-小鼠主动脉衰老相关蛋白p53、p21及p16均上调,sh STIM1下调细胞STIM1表达,并伴随着衰老相关蛋白p53、p21及p16表达以及ROS水平的增加;
(5) smc STIM1-/-小鼠主动脉组织转录组高通量测序显示下调基因富集在自噬与线粒体自噬中;
(6) smc STIM1-/-小鼠主动脉组织,超微结构下线粒体肿胀、嵴消失,线粒体面积及长度显著增加,线粒体分裂相关蛋白FIS1显著下调,线粒体融合蛋白MFN2表达上调,自噬相关蛋白PINK1、Parkin表达下调,p62表达上调;
(7) sh STIM1下调细胞STIM1表达后,自噬相关蛋白p62、LC3BII表达上调,进一步使用HCQ处理后,sh STIM1+HCQ组LC3BII表达量不高于sh NC+HCQ组。
(8) m RFP-GFP-LC3串联荧光蛋白系统检测,提示氧化应激衰老VSMCs模型自噬小体数量显著增多,而自噬溶酶体数量增加不变;在衰老VSMCs模型中过表达STIM1导致自噬溶酶体数量显著增多,并比自噬小体数量多,HCQ处理可逆转该过程。
(9)过表达STIM1能够减少衰老VSMCs p21、p16表达以及ROS水平上调,以及衰老相关β-半乳糖苷酶染色阳性细胞率增加,且HCQ处理后被逆转。
参考文献
[1]LncTRPM2-AS inhibits TRIM21-mediated TRPM2 ubiquitination and prevents autophagy-induced apoptosis of macrophages in asthma.Li Xiaoping;Wang Wenwen;Shao Yu;Zhou Ji;Huang Jiaqi;Xu Fei;Gao Xiu;Wu Mengyun;Dong Yongli;Wu Wenyan;Cai Jiamin;Wang Junyao;Ye Yunfei;Chen Zhengrong;Hao Chuangli;Yang Yi;Zhang Jinping.Cell Death&Disease,2021
[2]Deficiency of ROS-Activated TRPM2 Channel Protects Neurons from Cerebral Ischemia-Reperfusion Injury through Upregulating Autophagy.Hu Xupang;Wu Lijuan;Liu Xingyu;Zhang Yi;Xu Min;Fang Qiuyuan;Lu Lin;Niu Jianguo;Abd El Aziz Tarek Mohamed;Jiang Lin Hua;Li Fangfang;Yang Wei.Oxidative Medicine and Cellular Longevity,2021
[3]Keeping zombies alive:The ER-mitochondria Ca2+transfer in cellular senescence.Ahumada Castro Ulises;Puebla Huerta Andrea;Cuevas Espinoza Victor;Lovy Alenka;Cesar Cardenas J..Biochimica et Biophysica Acta(BBA)-Molecular Cell Research,2021
[4]Ang II Promotes Cardiac Autophagy and Hypertrophy via Orai1/STIM1.Zheng Chang Bo;Gao Wen Cong;Xie Mingxu;Li Zhichao;Ma Xin;Song Wencong;Luo Dan;Huang Yongxiang;Yang Jichen;Zhang Peng;Huang Yu;Yang Weimin;Yao Xiaoqiang.Frontiers in Pharmacology,2021
[5]曾鹏.钙感受器STIM1参与主动脉平滑肌细胞衰老的作用机制研究[D].华南理工大学,2022.
欢迎您浏览更多关于兔主动脉平滑肌细胞的相关新闻资讯信息



