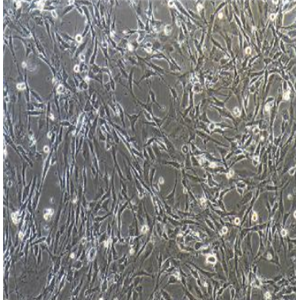
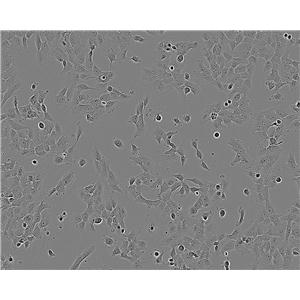
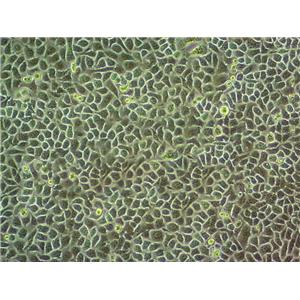
SVEC4-10的应用
发布日期:2023/8/17 10:23:54
背景[1-3]
SVEC4-10细胞在没有特殊添加剂的情况下无限生长,并且分化良好,像正常的内皮细胞一样对某些白细胞介素和细胞外基质信号作出反应,以进行管状分化。SVEC4-10生长在类似于合成基底的膜上时,它会形成管状分支网络。它们在体外与小鼠淋巴细胞特异性结合。细胞表达细胞表面主要组织相容性复合体I类抗原H-2 k,易被抗SV40 H-2 k CTL克隆裂解。干扰素γ(ifn-γ)诱导MHC II类抗原在一个与正常内皮细胞相同的时间过程中表达。细胞表达血管细胞粘附分子(VCAM),对sv40t抗原呈阳性染色。肿瘤坏死因子(TNF-)诱导SVEC4-10向梭形形态可逆转变。
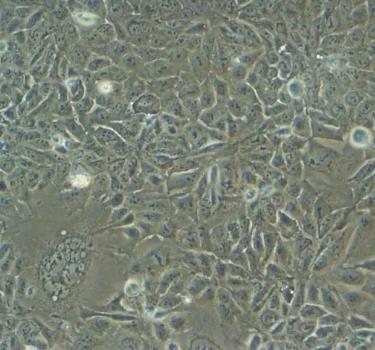
SVEC4-10
SVEC4-10细胞培养操作
1)复苏SVEC4-10细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4mL培养基混合均匀。在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入10cm皿中,加入约8ml培养基,培养过夜)。第二天换液并检查细胞密度。
2)SVEC4-10细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加1ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3.按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.将细胞悬液按1:2比例分到新的含8ml培养基的新皿中或者瓶中。
3)SVEC4-10细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为类;
1.细胞冻存时,弃去培养基后,PBS清洗一遍后加入1ml胰酶,细胞变圆脱落后,加入1ml含血清的培养基终止消化,可使用血球计数板计数。
2.4 min 1000rpm离心去掉上清。加1ml血清重悬细胞,根据细胞数量加入血清和DMSO,轻轻混匀,DMSO终浓度为10%,细胞密度不低于1x106/ml,每支冻存管冻存1ml细胞悬液,注意冻存管做好标识。
3.将冻存管置于程序降温盒中,放入-80度冰箱,2个小时以后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
SVEC4-10可以用于G-CSF在肝细胞癌中的表达及其作用机制的研究
G-CSF诱导的巨噬细胞可促进血管内皮细胞SVEC4-10的小管形成能力目的:采用G-CSF刺激单核细胞系(THP-1)后的条件培养基孵育SVEC4-10细胞,观察其促进血管内皮细胞小管形成能力,进一步探究G-CSF促进血管内皮细胞小管形成的作用机制。
H-方法:1.巨噬细胞条件培养基的提取人单核细胞系(THP-1)在含有10%FBS、1%双抗的1640培养基中培养,取对数增殖期的细胞加入终浓度为100ng/ml的G-CSF刺激THP-1细胞24小时后用DPBS彻底洗涤巨噬细胞并提供新的不含G-CSF的1640培养基继续培养巨噬细胞24小时,离心后的上清作为条件培养基用于血管内皮细胞小管形成实验。
2. SVEC4-10细胞加入40%各组条件培养基后孵育,8h后在倒置显微镜下观察并拍照,观测每个图像的总分支点与总管长度。
3. 免疫荧光法检测巨噬细胞内Mannose、i NOS的表达量。
4. 采用ELISA法检测巨噬细胞条件培养基中血管生成相关因子的分泌情况,包括VEGF、TGF-β。
结果:1.采用G-CSF处理过的巨噬细胞Mannose的表达量明显高升高,而i NOS的表达量极少(i NOS:0.979±0.068,Mannose:1.583±0.119);
2. ELISA检测结果显示,G-CSF处理过的巨噬细胞,其培养基中VEGF、TGF-β的含量均明显高于对照组(VEGF对照组:1.000±0.214,G-CSF组:3.982±0.313;TGF-β对照组:1.000±0.184,G-CSF组:4.586±0.196);
3. SVEC4-10细胞管腔形成实验结果表明采用G-CSF预处理过的巨噬细胞的条件培养基一起孵育的SVEC4-10参数均增加,相比较于对照组表现出较强的成管能力(总分支点对照组:92.000±9.165,G-CSF组:131.333±6.429;总管长度对照组:161.667±8.622,G-CSF组:213±13.892)。
结论:1.G-CSF可有效刺激THP-1细胞转化为M2型巨噬细胞。
2. 经G-CSF处理过的THP-1细胞能够分泌较多量血管生成相关因子VEGF、TGF-β到培养基中。
3. 采用G-CSF预处理过的巨噬细胞的条件培养基一起孵育的SVEC4-10参数均增加,相比较于对照组表现出较强的成管能力。
G-CSF通过激活PI3K/AKT/mTOR通路来促进SVEC4-10细胞的成管能力目的:采用G-CSF刺激单核细胞系(THP-1)后加入PI3K特异性抑制剂PI3K-IN-1与mTOR特异性抑制剂雷帕霉素来探究G-CSF通过诱导巨噬细胞分化进而促进血管形成能力的分子机制。
方法:1.人单核细胞系(THP-1)在含有10%FBS、1%双抗的1640培养基中培养,取对数增殖期的细胞分为4组分别为对照组、G-CSF组、G-CSF+PI3K-IN-1组、G-CSF+雷帕霉素组。收集各组上清作为条件培养基用于后续管腔形成实验,收集巨噬细胞用于后续通路相关蛋白检测。
2. SVEC4-10细胞加入40%各组条件培养基后孵育,8h后在倒置显微镜下观察并拍照,观测每个图像的总分支点与总管长度。
3. 采用Western Blot法检测巨噬细胞中PI3K/AKT/mTOR通路相关蛋白的表达量。
结果:1.采用G-CSF预处理过的巨噬细胞的条件培养基一起孵育的SVEC4-10参数均增加,相比较于对照组表现出较强的成管能力,而加入抑制剂后,这种促进作用均受抑制(总分支点对照组:186.667±10.017,G-CSF组:350±9.165,G-CSF+PI3K-IN-1组:209±16.093,G-CSF+雷帕霉素组:191.667±4.509;总管长度对照组:102.667±11.504,G-CSF组:193.333±9.610,G-CSF+PI3K-IN-1组:98.667±7.371,G-CSF+雷帕霉素组:101.667±7.024);
2. 采用G-CSF预处理过的巨噬细胞相对于对照组,PI3K/AKT/mTOR的磷酸化水平升高,而抑制剂则逆转了这一效应(对照组SHP-2:0.551±0.016,p-PI3K:0.893±0.013,p-AKT:0.572±0.018,p-mTOR:0.251±0.041;G-CSF组SHP-2:0.293±0.022,p-PI3K:1.340±0.050,p-AKT:1.059±0.018,p-mTOR:0.455±0.002;G-CSF+PI3K-IN-1组SHP-2:0.236±0.021,p-PI3K:0.881±0.034,p-AKT:0.688±0.021,p-mTOR:0.455±0.002;G-CSF+雷帕霉素组SHP-2:0.268±0.007,p-PI3K:0.895±0.032,p-AKT:0.579±0.061,p-mTOR:0.239±0.012)。
参考文献
[1]A case report of granulocyte colony-stimulating factor-producing hepatocellular carcinoma that recurred after long-term complete response.Takako Nomura;Asahiro Morishita;Joji Tani;Kei Takuma;Mai Nakahara;Kyoko Oura;Tomoko Tadokoro;Kiyoyuki Kobayashi;Koji Fujita;Shima Mimura;Hideki Kobara;Kunihiko Tsutsui;Takayuki Sanomura;Yoshihiro Nishiyama;Emi Ibuki;Reiji Haba;Teppei Sakamoto;Hirohito Yoneyama;Takashi Himoto;Tsutomu Masaki.Clinical Journal of Gastroenterology,2020
[2]G-CSF and G-CSFR Induce a Pro-Tumorigenic Macrophage Phenotype to Promote Colon and Pancreas Tumor Growth..Karagiannidis Ioannis;de Santana Van Vilet Eliane;Said Abu Egal Erika;Phinney Brandon;Jacenik Damian;Prossnitz Eric R.;Beswick Ellen J..Cancers,2020
[3]Tumor Microenvironment.Borros Arneth.Medicina,2019
[4]Tumor-associated macrophages(TAMs)depend on Shp2 for their anti-tumor roles in colorectal cancer..Wang Saisai;;Yao Yuanyuan;;Li Huixia;;Zheng Gang;;Lu Sen;;Chen Wenbin.American journal of cancer research,2019
[5]曹恒.G-CSF在肝细胞癌中的表达及其作用机制的研究[D].河北医科大学,2023.
欢迎您浏览更多关于SVEC4-10的相关新闻资讯信息