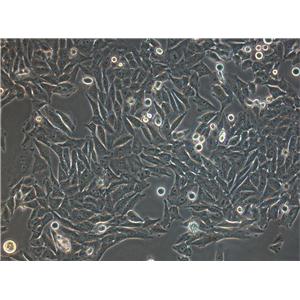
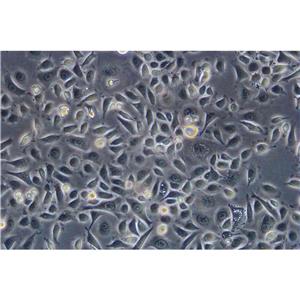
HUCC-T1人胆管癌贴壁细胞系的应用
发布日期:2023/8/7 11:56:06
背景[1-3]
HUCC-T1人胆管癌贴壁细胞系是从一名56岁患者腹水恶性细胞中分离得到的。原发性肝肿瘤的组织学表现为中分化的腺癌。用含0.2%乳白蛋白水解物的RPMI 1640培养基对腹水肿瘤细胞进行培养,培养细胞在第25代呈指数增长,呈单层生长,增殖时间为74 h。呈上皮样形态,粘液染色阳性。超微结构研究显示细胞表面存在微绒毛,细胞质中细胞器发育不良。裸鼠中具有致瘤性。hucc-t1染色体数目在61~80条之间。
这些人胆管细胞癌细胞在无血清培养基中分泌多种肿瘤标志物,包括碳水化合物抗原19/9、碳水化合物抗原125、癌胚抗原和组织多肽抗原。在含1%胎牛血清的RPMI 1640培养基中培养的hucc-t1细胞碳水化合物抗原19/9分泌水平是含0.2%乳钙蛋白水解物的6倍。这些结果提示hucc-t1将为阐明人胆管细胞癌肿瘤标志物分泌和肿瘤细胞生长的机制提供有用的信息。
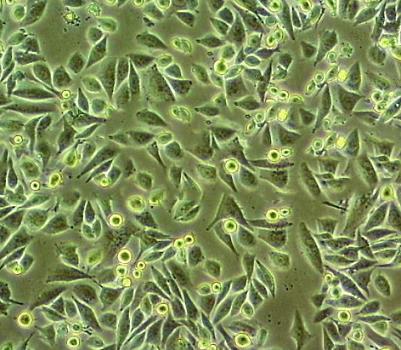
HUCC-T1人胆管癌贴壁细胞系
HUCC-T1人胆管癌贴壁细胞系细胞培养操作
1)复苏HUCC-T1人胆管癌贴壁细胞系细胞:以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀。在1000 rpm条件下离心3 min,弃去上清液,加1-2 mL培养基后吹匀。然后将所有细胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入10 cm皿中,加入约8 mL培养基,培养过夜)。第二天换液并检查细胞密度。
2)HUCC-T1人胆管癌贴壁细胞系细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1 mL消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,使消化液浸润所有细胞,弃去消化液,将培养瓶置于37℃培养箱中消化1 min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
c、按6-8 mL/瓶补加培养基,轻轻打匀后装入无菌离心管中,1000 rpm离心4 min,弃去上清液,补加1-2 mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
3)HUCC-T1人胆管癌贴壁细胞系细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
HUCC-T1人胆管癌贴壁细胞系可以用于NK4通过HIF-1α/VEGF途径对胆管癌微血管生成和侵袭的影响
研究分别从体外实验和动物模型两个方面,探讨NK4基因对HIF-1α/VEGF通路介导的CCA微血管生成和侵袭的影响。
方法:1.NK4(Hu-NK4)和对照质粒(Hu-Em)稳转的人胆管癌HuCC-T1细胞株在常氧或缺氧条件下用HGF处理,分别通过MTT、Transwell侵袭试验和流式细胞术分析CCA细胞的增殖、侵袭和凋亡;
2.用HuCC-T1/Em和HuCC-T1/NK4稳转细胞株建立裸鼠CCA皮下移植瘤模型,通过测量瘤体的大小和重量分析异种移植小鼠模型中人CCA的肿瘤生长,通过免疫组化测定CD31阳性微血管分析肿瘤血管的生成,通过Real-time-PCR和Western-blotting分析缺氧诱导因子1-α(HIF-1α)、血管内皮生长因子(VEGF)和CD31的表达。
结果:1.在常氧和缺氧条件下,过表达NK4显著抑制HuCC-T1细胞的增殖;并且,在缺氧条件下,NK4对HuCC-T1细胞增殖的抑制作用显著增强;
2.在常氧和缺氧条件下,过表达NK4显著促进HuCC-T1细胞凋亡;并且,在缺氧条件下,NK4诱导的HuCC-T1细胞凋亡显著增强;
3.过表达NK4使HuCC-T1细胞侵袭力减弱,并可抑制缺氧的促侵袭作用;
4.缺氧可上调HuCC-T1细胞中的HIF-1α,CD31和VEGF基因的表达,过表达NK4下调HIF-1α、CD31和VEGF表达,抑制缺氧的促微血管生成作用;
5.在HuCC-T1细胞移植小鼠模型中,过表达NK4抑制瘤体生长;
6.过表达NK4下调CCA肿瘤组织中HIF-1α、CD31和VEGF基因的表达,抑制肿瘤微血管的生成。
结论:1.HGF拮抗剂NK4在体外显著抑制胆管癌HuCC-T1细胞的增殖和侵袭,并诱导HuCC-T1细胞凋亡;
2. NK4抑制HuCC-T1细胞HIF-1α、VEGF和CD31等因子的表达,并显著抑制缺氧诱导的促肿瘤微血管的生成;
3.在胆管癌小鼠模型中,NK4通过抑制肿瘤组织HIF-1α、VEGF和CD31等因子的表达,显著抑制肿瘤的生长和微血管形成。
参考文献
[1]Intrabiliary radiofrequency heating-enhanced direct intratumoral GFP/HSV-TK gene therapy of cholangiocarcinoma:A preclinical study on mice and pigs.F Zhang;;Y JIN;;S Jingjing;;J Gao;;X Yang.Journal of Vascular and Interventional Radiology,2017
[2]HIF‐1 at the crossroads of hypoxia,inflammation,and cancer.Kuppusamy Balamurugan.Int.J.Cancer,2016
[3]Patients with large‐duct primary sclerosing cholangitis and Crohn's disease have a better outcome than those with ulcerative colitis,or without IBD.J.Fevery;;W.Van Steenbergen;;J.Van Pelt;;W.Laleman;;I.Hoffman;;K.Geboes;;S.Vermeire;;F.Nevens.Aliment Pharmacol Ther,2016
[4]Gemcitabine and Oxaliplatin,but Not Sorafenib or Paclitaxel,Have a Synergistic Effect with Yttrium-90 in Reducing Hepatocellular Carcinoma and Cholangiocarcinoma Cell Line Viability.Julien Edeline;;Cédric Coulouarn;;Laurence Crouzet;;Marc Pracht;;Nicolas Lepareur;;Bruno Clément;;Etienne Garin.Journal of Vascular and Interventional Radiology,2015
[5]谢睿.NK4通过HIF-1α/VEGF途径对胆管癌微血管生成和侵袭的影响[D].南京医科大学,2017.
欢迎您浏览更多关于HUCC-T1人胆管癌贴壁细胞系的相关新闻资讯信息