25-羟基维生素D3的合成研究进展
发布日期:2023/6/26 10:36:57
介绍
25-羟基维生素D3是维生素D3的衍生物,是一种保持骨骼健康的重要营养素,在刺激肠道吸收钙、调节骨钙和促进磷的吸收方面比维生素D3更有价值。与维生素D3相比,因增加了一个羟基水溶性增强,在血液中流通更容易,在血清中的含量是维生素D3的3.1倍,生物活性是维生素D3的20~40倍,比维生素D3更容易吸收,可以从肠道直接吸收进入血液循环等。现代研究表明,25-羟基维生素D3在血浆中的含量,是机体维生素D3营养状态的指示剂,但通过提高日粮中维生素D3水平无法达到同样效果[1,2]。

图一 25-羟基维生素D3
合成进展
自1978年以来,罗氏/帝斯曼虽然已经逐步实现工业规模的半合成路线生产维生素D类,但却直到1995年,他们才基于D.R.Andrews等人的方法,实现商业化半合成25-羟基维生素D3。换句话说,25-羟基维生素D3的合成并非想像的那般容易,而至今25-羟基维生素D3主要是通过化学半合成制得,且普遍以两种路线为主,即先开环法和后开环法。
先开环法
2014年,德国BASF科学家Bernd Schaefer编著《Natural Products in the Chemical Industry》一书[3],该书在7.2章节描述25-羟基维生素D3的化学半合成方法——先开环法,该法简述如下:
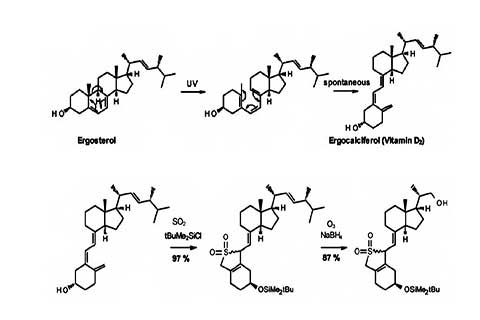
(1)以麦角甾醇为原料,经过光照开环、加热重排得到前维生素D2,即麦角钙化醇(文中未提供收率);
(2)再用叔丁基二甲基氯硅烷上羟基保护,同时用SO2保护共轭双键,该步收率97%;
(3)接着用O3氧化断开链上双键获得目标醛,再用NaBH4还原为伯醇,该步收率87%;
(4)还原产物脱SO2双烯保护基,该步收率仅仅47%;
(5)脱保护后用对苯磺酰氯进行磺酰化,酰化收率仅58%;
(6)酰化产物再与C5片段格氏试剂发生格氏反应,之后进行脱硅醚保护基制得25-羟基维生素D3,该步收率为82%。前两步未提及收率,而后五步的总收率仅为22%。BASF和罗氏主要以该路线进行合成25-羟基维生素D3。化学反应路线如图二所示。
图二 25-羟基维生素D3化学反应路线
David R.Andrews等人[4]于1986年以麦角甾醇为起始原料,先开环获得维生素D2(该步不提供反应实例),再对VD2共轭双键保护,保护收率86%,同时硅醚化保护羟基,再进行臭氧化分解反应等一系列操作,对这些反应步骤进行详细的综述分析,同时给出相应的实例,这是先开环法比较全面的文献[2]。
1995年,Percy S.Mawhand等人[5]以维生素D2为起始原料合成25-羟基维生素D3,维生素D2使用SO2对共轭双键进行保护,再对环上羟基进行硅醚化保护,以97%收率获得相应中间体;接着对该中间体进行臭氧化分解并还原,以87%收率获得相应的还原产物;再用碘单质与三苯基膦处理还原产物以71%收率得到碘代物;碘代物在碳酸氢钠乙醇溶液中脱去双键保护基,以92%收率获得开环的硅醚碘化物;该硅醚碘化物与丙烯甲酮(或丙烯酸乙酯)在六水合氯化镍/Zn存在下,于吡啶中缩合并以73%收率获得相应的酮,最后酮与甲基格氏试剂反应得到目标产物25-羟基维生素D3[3]。
Gilles和Chambournier[6]于1999年以麦角甾醇为起始原料,先光照开环异构合成维生素D2,并给出相应的实例,然而仅以44%~51%的收率获得维生素D2(以麦角甾醇计),收率极低,工业化价值较小。
后开环法
2012年,日本信一郎[8]等人以麦角甾醇为起始原料,合成25-羟基维生素D3,即后开环法,简述如下:
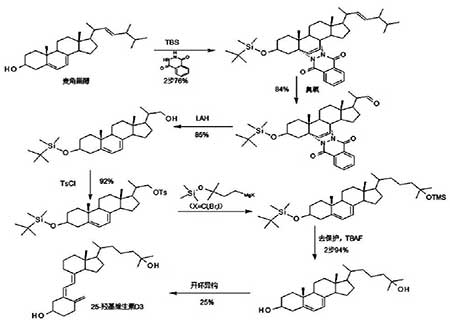
(1)以麦角甾醇为起始原料,先羟基硅醚化保护,再用苯肼保护共轭双键,得到麦角甾硅醚肼(两步合并收率为76%);
(2)麦角甾硅醚肼臭氧化分解得到醛(该步收率84%),再用还原剂氢化铝锂还原去双烯保护得到硅醚醇(该步收率85%);
(3)麦角甾硅醚醇用酰氯酯化羟基得到酯(该步收率92%),酯与C5格氏试剂反应得到相应的C27片段;
(4)再经去保护(该步收率94%)、开环、异构等步骤得到目标产物25-羟基维生素D3(开环异构收率仅为25%)。该方法从麦角甾醇一直到开环前,各步骤收率均较高(开环前总收率约47%),但光照开环异构收率仅25%,导致总收率低至11.73%,使得该路线丧失原有竞争力,若光照开环步骤收率提高至45%以上,后开环法则比先开环法优势大增。化学反应路线如图三所示。
图三 25-羟基维生素D3化学反应路线二
根据近几十年的文献分析比较,以麦角甾醇为起始原材料,综合各个研究者的优势,避开劣势。后开环法理论上可以做到25-羟基维生素D3总收率为35%~41%,而先开环法总收率仅能做到19.8%。从工艺实施、环境保护、经济效益等方面进行分析,后开环法均具备不可替代的优势,更具有深入探讨研究的意义。
参考文献
[1]廖艳金,方泽华,姚伟平,蒙美壮.25-羟基维生素D_3的合成研究进展[J].广东化工,2022,49(13):111-113+125.
[2]张金龙,张宁,杨雪等.25-羟基维生素D3对肉鸡生长性能、骨骼矿化及肠道维生素D受体基因表达的影响[J].中国饲料,2017,No.596(24):24-29.
[3]Bernd Schaefer.Natural Products in the Chemical Industry[M].Berlin:Springer-verlag,2014.
[4]David R Andrews,Derek H R Barton,Robert H Heme,et al.Synthesis of25-Hydroxy-and la,25-Dihydroxyvitamin D3 from Vitamin D2(Calciferol)[J].J Org Chem,1986,51:4819-4828.
[5]Percy S Mawhand,George P Yiannikouros,Peter S Belica.Nickel-mediated conjugate addition elaboration of calcitriolfromergocalciferol[J].J Org Chem,1995,60:6574-6581.[6]Gilles Chambournier, David J. Hart. Vitamin D2 fromergosterol[9,10-Secoergosta-5,7,10(19),22-tetraen-3-ol,(3β)-from ergosta-5,7,22-trien-3-ol,(3β)-][J].Organic Syntheses Coll,1999,76,275.
[7]Zanello L P,Norman A W.Electrical responses to 1α,25(OH)2-Viamin D3and their physiological significance in osteoblasts[J].Steroids,2004,69:561-565.
[8]信一郎,宇藤由人,田边信岳,等.Continuous-flow synthesis of activated vitamin D3 and its analogues[J].Org Biomol Chem,2012,10:5205-5211.



