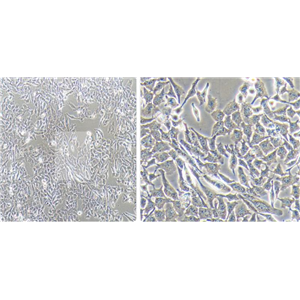
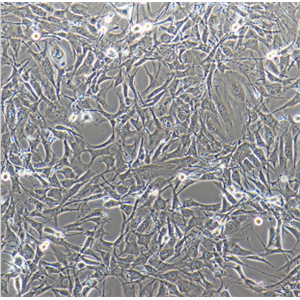
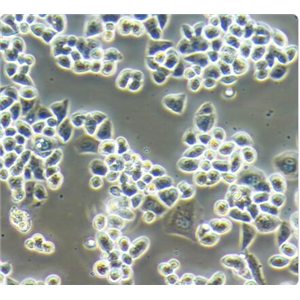
人骨髓间充质干细胞的应用
发布日期:2023/5/26 13:27:31
背景[1-3]
人骨髓间充质干细胞来源于发育早期的中胚层和外胚层,属于多能干细胞,MSCs可以在体内或体外特定的诱导条件下,分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞。
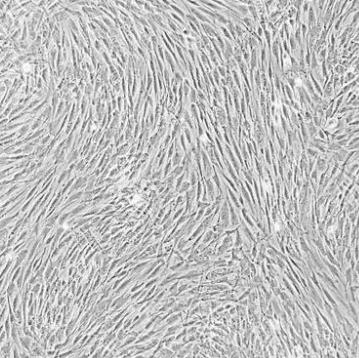
人骨髓间充质干细胞
人骨髓间充质干细胞培养步骤
一.人骨髓间充质干细胞培养基及培养冻存条件准备:
1)准备人骨髓间充质干细胞培养基(GIBCO,,添加NaHCO3 1.5g/L,丙酮酸钠0.11g/L);优质胎牛血清,10%。
2)人骨髓间充质干细胞培养条件:气相:空气,95%;二氧化碳,5%。温度:37摄氏度,培养箱湿度为70%-80%。
3)人骨髓间充质干细胞冻存液:90%完全培养基,10%DMSO,现用现配。液氮储存。
二.细胞处理:
1)复苏人骨髓间充质干细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4mL培养基混合均匀。在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入10cm皿中,加入约8ml培养基,培养过夜)。第二天换液并检查细胞密度。
2)人骨髓间充质干细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
对于贴壁人骨髓间充质干细胞,传代可参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加2ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3.按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.将人骨髓间充质干细胞悬液按1:2到1:5的比例分到新的含8ml培养基的新皿中或者瓶中。
3)人骨髓间充质干细胞冻存:待细胞生长状态良好时,可进行细胞冻存。贴壁细胞冻存时,弃去培养基后加入少量胰酶,细胞变圆脱落后,加入约1ml含血清的培养基后加入冻存管中,再添加10%DMSO后进行冻存。
应用[4][5]
人骨髓间充质干细胞可以用于miR-155-5p调控Sort1参与人骨髓间充质干细胞成脂分化
成人骨髓间充质干细胞(human Mesenchymal Stem Cells,hMSCs)定向分化为成骨细胞和脂肪细胞的比例失衡(成骨细胞减少、脂肪细胞增多),将导致骨量下降,是骨质疏松发生发展的关键因素。因此,hMSCs的成脂分化调控机制是骨质疏松研究的重要基础理论问题之一。Micro RNAs是近年来证实的影响成脂分化的重要调节因子,其中miR-155在hMSCs定向分化中发挥调控作用,但其在成脂分化机制尚不清楚,明确miR-155-5p调控Sort1参与人骨髓间充质干细胞成脂分化机制,为骨质疏松症、肥胖等临床相关疾病的防治提供理论依据。
方法:1、hMSCs细胞周期和表面标记的检测hMSCs纯化传代培养,流式细胞术分析细胞周期,同时用流式细胞术检测hMSCs表面标记:CD14、CD34、CD45、HLA-DR;CD29、CD44、CD90、CD105;Moμse Ig2a、Moμse Ig1阴性对照。
2、正常成脂诱导,hMSCs成脂效率评价第六代hMSCs细胞给予成脂分化诱导液诱导7天,14天,油红O染色后观察脂滴形成情况;qRT-PCR分析Ap2、PPARγ、CEBPα等成脂标志性基因的表达,Western blot检测蛋白表达水平。
3、miR-155-5p的表达检测miR-155-5p在hMSCs细胞给予成脂分化诱导液诱导7天、14天脂肪形成过程中,采用qRT-PCR分析miR-155-5p的表达。
4、过表达miR-155-5p后,hMSCs成脂效率评价转染过表达miR-155-5p慢病毒后,荧光显微镜下观察细胞形态及转染效率。转染后,进行细胞成脂诱导,在不同时间节点收集细胞,油红O进行染色,观察结果,异丙醇洗脱后,酶标仪490nm测量OD值,以定量细胞内脂滴积累情况;采用qRT-PCR技术检测基因表达情况,Western blot检测蛋白表达水平。
5、miR-155-5p及其靶基因的筛选和验证针对hMSCs成脂分化过程,运用Illumina Hi Seq X ten平台实施Small RNA动态测序,关联m RNA-seq(转录组测序)结果,联合分析miRNA及m RNA的表达趋势,聚类分析差异表达miRNA与m RNA,再结合靶基因预测数据库(Target Scan、miRanda和Pic Tar)预测miRNA潜在靶基因,聚焦miR-155-5p及潜在靶基因Sort1。qRT-PCR、Western blot检测Sort1在hMSCs成脂分化过程中基因表达及蛋白水平;采用双荧光素酶技术验证miR-155-5p靶向作用Sort1基因。
6、Sort1基因表达和蛋白水平检测过表达miR-155-5p后,细胞给予成脂分化诱导液诱导7天,14天,qRT-PCR技术检测靶基因Sort1的表达水平,Western blot检测蛋白表达。
结果:1、检测结果显示细胞周期:S+G2/M期细胞15%,G0/G1期的细胞85%。hMSCs表面标记:CD14、CD34、CD45、HLA-DR(阴性结果);CD29、CD44、CD90、CD105(阳性结果);Moμse Ig2a、Moμse Ig1阴性对照。hMSCs同时满足细胞周期和表面标记的要求。
2、正常成脂诱导,油红O染色结果显示脂滴明显增多,qRT-PCR检测结果显示成脂标志基因表达明显逐渐升高,成脂效率高。
3、hMSCs成脂分化过程中,qRT-PCR检测结果显示miR-155-5p表达呈明显逐渐下降趋势。
参考文献
[1]Effects of the Wenyang Zhenshuai Granule on the Expression of LncRNA-MiR143HG/miR-143 Regulating ERK5 in H9C2 Cardiomyocytes[J].Xu Zelin;Chen Xinyu;Chen Qingyang;Cai Huzhi;Tan Songwen.Evidence-Based Complementary and Alternative Medicine,2021
[2]Candidate kinases for adipogenesis and osteoblastogenesis from human bone marrow mesenchymal stem cells.[J].Yi Xia;Wu Ping;Liu Jianyun;He Shan;Gong Ying;Xiong Jianjun;Xu Xiaoyuan;Li Weidong.Molecular omics,2021
[3]MicroRNA-210-3p Promotes Chondrogenic Differentiation and Inhibits Adipogenic Differentiation Correlated with HIF-3 Signalling in Bone Marrow Mesenchymal Stem Cells[J].Yang Meng;Yan Xin;Yuan Fu-Zhen;Ye Jing;Du Ming-Ze;Mao Zi-Mu;Xu Bing-Bing;Chen You-Rong;Song Yi-Fan;Fan Bao-Shi;Yu Jia-Kuo;Xu Yanming.BioMed Research International,2021
[4]Regulatory microRNAs in Brown,Brite and White Adipose Tissue.[J].Gharanei Seley;Shabir Kiran;Brown James E;Weickert Martin O;Barber Thomas M;Kyrou Ioannis;Randeva Harpal S.Cells,2020(11)
[5]刘建云.miR-155-5p调控Sort1参与人骨髓间充质干细胞成脂分化[D].南昌大学,2022.
欢迎您浏览更多关于人骨髓间充质干细胞的相关新闻资讯信息