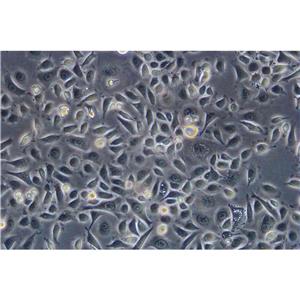
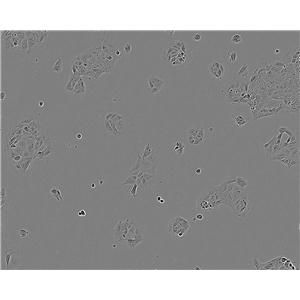
人肾透明细胞癌皮肤转移细胞;Caki-1的简介
发布日期:2023/2/28 10:53:10
简介[1-3]
人肾透明细胞癌皮肤转移细胞;Caki-1的超微结构中包含许多微绒毛、少许微丝、许多小线粒体、充分发育的高尔基体、内质网、许多脂滴和多层体,次级溶酶体;目前,没有在Caki-1细胞内发现病毒颗粒。
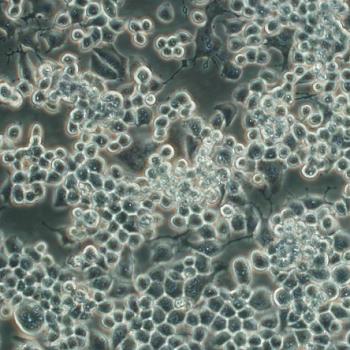
人肾透明细胞癌皮肤转移细胞;Caki-1
人肾透明细胞癌皮肤转移细胞;Caki-1细胞特性
1)来源:肾透明细胞癌皮肤转移
2)形态:上皮细胞样贴壁生长
3)含量:>1x106细胞数
4)规格:T25瓶或者1mL冻存管包装
运输和保存
干冰运输及复苏好存活细胞
(1)1mL冻存管包装干冰运输,收到后-80度冰箱保存过夜后转入液氮或直接复苏。
(2)T25瓶复苏的存活细胞常温发货,收到后按照细胞接收后的处理方法操作。
人肾透明细胞癌皮肤转移细胞;Caki-1细胞接收后的处理:
1)收到细胞后,75%酒精消毒瓶壁将T25瓶置于37℃培养箱放置约2-3h,若发现培养瓶破损、有液溢出及细胞有污染。
2)请在4或5X显微镜下确认细胞状态,同时给刚收到的细胞拍照(10×,20×)各2-3张以及培养瓶外观照片一张留存,作为售后时收到时细胞状态的依据。
3)贴壁细胞:细胞在37℃培养箱中放置2-3h,显微镜下观察细胞的生长和贴壁情况,有些贴壁细胞在快递运送过程中会因振动脱落和脱落后成团的情况。若镜下观察细胞的生长密度若在60%以下,可去除培养瓶中灌液培养基(若有未贴壁的细胞需要离心回收,重悬打入到原培养瓶中),加入新配制的完全培养基6-8mL,放到细胞培养箱中继续培养。若细胞生长密度达70%-80%以上,可以对细胞进行传代处理。传代过程中,若因运输振动脱落的细胞需要离心回收。
4)备注:运输用的培养基(灌液培养基)不能再用来培养细胞,请换用按照说明书细胞培养条件新配制的完全培养基来培养细胞。收到细胞后次传代建议T25培养瓶1:2传代。
一.培养基及培养冻存条件准备:
1)准备Mccoy’s 5A培养基;优质胎牛血清,10%;双抗,1%。
2)培养条件:气相:空气,95%;二氧化碳,5%。温度:37摄氏度,培养箱湿度为70%-80%。
3)冻存液:90%血清,10%DMSO,现用现配。
二.细胞处理:
1)冻存细胞的复苏:
将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入到含4-6mL完全培养基的离心管中混合均匀。在1000RPM条件下离心3-5min,弃去上清液,完全培养基重悬细胞。然后将细胞悬液加入含6-8ml完全培养基的培养瓶(或皿)中37℃培养过夜。第二天显微镜下观察细胞生长情况和细胞密度。
2)细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
对于贴壁细胞传代可以参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加入0.25%(w/v)胰蛋白酶-0.53 mM EDTA于培养瓶中(T25瓶1-2mL,T75瓶2-3mL),置于37℃培养箱中消化1-2分钟(难消化的细胞可以适当延长消化时间),然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加入3-4ml含10%FBS的培养基来终止消化。
3.轻轻打匀后吸出,在1000RPM条件下离心3-5min,弃去上清液,补加1-2mL培养液后吹匀。将细胞悬液按1:2的比例分到新T25瓶中,添加6-8ml按照说明书要求配置的新的完全培养基以保持细胞的生长活力,后续传代根据实际情况按1:2~1:5的比例进行。
3)细胞冻存:收到细胞后建议在培养前3代时冻存一批细胞种子以备后续实验使用。
1.细胞冻存时按照细胞传代的过程收集消化好的细胞到离心管中,可使用血球计数板计数,来决定细胞的冻存密度。一般细胞的推荐冻存密度为1×106~1×107个活细胞/ml.
2.1000rpm离心3-5min,去掉上清。用配制好的细胞冻存液重悬细胞,按每1ml冻存液含1×10^6~1×10^7个活细胞/ml分配到一个冻存管中将细胞分配到冻存管中,标注好名称、代数、日期等信息。
3.将要冻存的细胞置于程序降温盒中,-80度冰箱中过夜,之后转入液氮容器中储存。同时记录好冻存管在液氮容器中的位置以便后续查阅和使用。
参考文献
[1]Immunoexpression Status and Prognostic Value of mTOR and Hypoxia-Induced Pathway Members in Primary and Metastatic Clear Cell Renal Cell Carcinomas[J].Luciana Schultz;;Alcides Chaux;;Roula Albadine;;Jessica Hicks;;Jenny J.Kim;;Angelo M.De Marzo;;Mohamad E.Allaf;;Michael A.Carducci;;Ronald Rodriguez;;Hans-Joerg Hammers;;Pedram Argani;;Victor E.Reuter;;George J.Netto.The American Journal of Surgical Pathology,2011(10)
[2]Hypoxia-mediated drug resistance:Novel insights on the functional interaction of HIFs and cell death pathways[J].Nadine Rohwer;;Thorsten Cramer.Drug Resistance Updates,2011(3)
[3]Oxygen homeostasis[J].Gregg L.Semenza.WIREs Syst Biol Med,2010(3)
欢迎您浏览更多关于人肾透明细胞癌的相关新闻资讯信息