LLC小鼠肺癌细胞的应用
发布日期:2022/3/16 9:33:26
背景[1-3]
LLC小鼠肺癌细胞是从小鼠肺癌组织中分离并培养成的稳定原代细胞系,商品化的小鼠肺癌细胞LLC主要来源ATCC、DSMZ、ECACC、RIKEN、LLC小鼠肺癌细胞promocell、ScienCell、ECACC、JCRB、KCLB、Asterand、ICLC等细胞系。
原代培养是直接从生物体获取组织或器官的一部分进行培养,也称初代培养。严格地说即从体内取出组织接种培养到次传代阶段,但实际上,通常把代至第十代以内的培养细胞统称为原代细胞培养。一般持续1一4周。此期细胞呈活跃的移动,可见细胞分裂,但不旺盛。原代培养细胞与体内原组织在形态结构和功能活动上相似性大。由于培养的细胞刚刚从活体组织分离出来,故更接近于生物体内的生活状态。
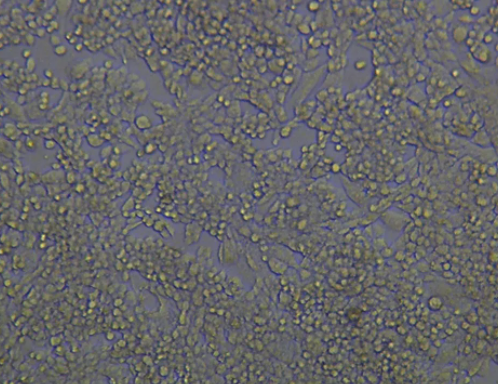
LLC小鼠肺癌细胞
细胞处理:
1)复苏细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4mL培养基混合均匀。在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入250px皿中,加入约8ml培养基,培养过夜)。第二天换液并检查细胞密度。
2)细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
对于贴壁细胞,传代可参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加2ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3.按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.收到细胞后首次传代推荐将细胞悬液按1:2的比例分到新的含6ml培养基的新皿中或者瓶中,建议客户冻存一支备用,后续传代根据实际情况按1:2到1:5的比例进行。
3)细胞冻存:待细胞生长状态良好时,可进行细胞冻存。
应用[4][5]
用于抑制Rac1减轻小鼠放射性肺损伤并增敏肺癌放疗的作用与机制研究
针对Rac1在胸部放疗所致肺损伤中的作用进行研究,从动物和细胞两个水平观察抑制Rac1对放射性肺损伤的防护效果,另一方面验证其对肿瘤放疗的影响。并进一步通过转录组测序及分析,筛选并验证Rac1下游的作用分子,从而阐明Rac1与放射性肺损伤及肿瘤放疗关系的作用机制。
探索抑制Rac1对放射性肺损伤的防护作用及机制,验证抑制Rac1对正常肺组织与肿瘤细胞的差异效应,探索介导该差异效应的分子机制。
方法:使用60Co放射源,构建放射性肺损伤小鼠模型,使用Rac1特异性抑制剂NSC23766和H&E染色、Masson染色方法,研究抑制Rac1对模型小鼠照射后肺组织肺炎、肺纤维化程度的影响,并通过免疫组织化学染色法研究抑制Rac1对模型小鼠照射后肺组织DNA损伤标志物磷酸化H2AX(γ-H2AX)、放射损伤标志物TGF-β和EMT标志物vimentin的表达影响。
使用小鼠正常肺上皮细胞系MLE-12,使用Rac1特异性抑制剂NSC23766及构建Rac1敲除细胞系的方式,通过免疫蛋白印迹法(Western Blot,WB)研究放射后凋亡相关蛋白、细胞周期相关蛋白及DNA损伤相关蛋白表达变化,通过流式细胞仪检测细胞凋亡率、PI/RNase染色法检测细胞周期分布、Ed U法检测细胞增殖活力,从细胞水平上验证抑制Rac1对放射性肺损伤的保护效应。通过转录组测序寻找抑制Rac1引起的差异基因表达,筛选抑制Rac1介导其效应的可能通路,实时荧光定量PCR(quantitative real-time PCR,q PCR)法验证转录组测序结果,从细胞水平上研究介导Rac1差异作用的分子机制。
进一步利用小鼠肺癌细胞系LLC研究抑制/敲除Rac1对肿瘤细胞的辐射增敏效应。最后,构建裸鼠皮下荷瘤模型、小鼠肺部原位荷瘤模型,结合使用Rac1抑制剂NSC23766,进一步在体验证抑制Rac1对正常肺组织与肿瘤细胞的双向作用。
研究结果:(1)Rac1抑制剂NSC23766可减轻小鼠放射性肺炎及肺纤维化;(2)抑制或敲除Rac1对MLE-12细胞的增殖活力无明显影响,可减少MLE-12细胞照射后凋亡、逆转MLE-12细胞照射后G2/M期阻滞、减轻MLE-12细胞照射后DNA损伤;(3)敲除Rac1可下调肿瘤蛋白p53诱导核蛋白1(Tumor protein p53-inducible nuclear protein 1,Trp53inp1),过表达Trp53inp1可部分逆转敲除Rac1对MLE-12的辐射防护效应;(4)抑制或敲除Rac1可显著抑制LLC细胞增殖活力、增加LLC细胞照射后凋亡,对LLC细胞照射后周期阻滞无明显影响;(5)过表达Trp53inp1可协同敲除Rac1的促LLC凋亡效应,对小鼠肺癌细胞周期及增殖活力无明显影响;(6)肿瘤细胞LLC的Rac1表达显著高于正常肺上皮细胞MLE-12,且存在Rac1插入突变;(7)肿瘤细胞LLC的Trp53inp1表达显著低于正常肺上皮细胞MLE-12;
参考文献
[1]Compartmentalisation of RAC1 signalling[J].Aishwarya Payapilly,Angeliki Malliri.Current Opinion in Cell Biology.2018
[2]Relevance of small GTPase Rac1 pathway in drug and radio-resistance mechanisms:Opportunities in cancer therapeutics[J].G.A.Cardama,D.F.Alonso,N.Gonzalez,J.Maggio,D.E.Gomez,C.Rolfo,P.L Menna.Critical Reviews in Oncology/Hematology.2018
[3]Oncogenic RAC1 and NRAS drive resistance to endoplasmic reticulum stress through MEK/ERK signalling[J].Michael D.Bright,Paul A.Clarke,Paul Workman,Faith E.Davies.Cellular Signalling.2018
[4]The role of small GTPases of the Rho/Rac family in TGF‐β‐induced EMT and cell motility in cancer[J].Hendrik Ungefroren,David Witte,Hendrik Lehnert.Developmental Dynamics.2018(3)
[5]安妮.抑制Rac1减轻小鼠放射性肺损伤并增敏肺癌放疗的作用与机制[D].中国人民解放军海军军医大学,2020.
欢迎您浏览更多关于LLC小鼠肺癌细胞的相关新闻资讯信息