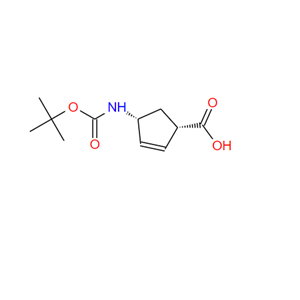
(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸的制备方法
发布日期:2022/2/7 9:55:23
背景及概述[1]
(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸是一种有机中间体,可由(1R,4S)-2-氮杂双环[2.2.1]庚-5-烯-3-酮与HCl水溶液反应得到(1S,4R)-4-氨 基环戊-2-烯甲酸盐酸盐,然后再与重 碳酸二叔丁基酯反应得到(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸。

制备[1-2]
报道一、
向(1R,4S)-2-氮杂双环[2.2.1]庚-5-烯-3-酮(5.0g,46mmol)/水(30.5ml)溶 液中添加HCl水溶液(2M,23.0ml,46.0mmol)。在约80℃加热约2小时以 后,将反应混合物冷却至环境温度并且在减压下除去溶剂。固体在真空烘 箱中在约70℃干燥并且使用而无需进一步提纯。在约0℃向(1S,4R)-4-氨 基环戊-2-烯甲酸盐酸盐(9.20g,45.8mmol)/1,4-二氧杂环己烷(15ml)和水 (18.3ml)溶液中添加DIEA(32.0ml,183mmol)。在搅拌约5分钟后,添加重 碳酸二叔丁基酯(di-tert-butyl dicarbonate)(11.7ml,50.4mmol)/1,4-二氧杂环 己烷(5ml)的溶液。使反应混合物升温至周围温度并且搅拌约18小时。在 减压下除去溶剂并且在真空烘箱中在约65℃干燥粗制的油约3小时。用 80-100%EtOAc/庚烷的梯度洗脱通过硅胶色谱法提纯粗产物,得到(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸(5.2g,50%,两个步骤): LC/MS(表2,方法a)Rt=1.81min;MS m/z:226(M-H)-。
报道二、
步骤1:(±)‑2‑N‑BOC‑氮杂双环[2,2,1]庚‑5‑烯‑3‑酮:于室温下,将二碳酸二‑叔丁基酯(144g,660.5mmol)的THF(100ml)的溶液加至(20分钟)搅拌的(±)‑2‑氮杂双环[2,2,1]庚‑5‑烯‑3‑酮(60g,549.8mmol)、三乙胺(83.5g,824.6mmol)和4‑二甲基氨基吡啶(6.7g,54.8mmol)的THF(500ml)溶液中。将反应混合物于室温下再搅拌4小时。减压蒸发除去溶剂,残留物用EtOAc(800ml)稀释,用水(3×500ml)和盐水(400ml)洗涤。将EtOAc萃取液干燥(Na2SO4)并减压蒸发得到115g化合物,为白色固体;IR(KBr)2979,1755,1705,1455,1331,1305,1149,1117cm‑1;1H NMR(CDCl3,300MHz)δ1.50(s,9H),2.13‑2.16(m,1H),2.33‑2.37(m,1H),3.38‑3.40(m,1H),4.94‑4.96(m,1H),6.64‑6.66(m,1H),6.88‑6.90(m,1H)。
步骤2:顺式‑(±)‑4‑N‑BOC‑氨基环戊‑2‑烯‑1‑甲酸:向搅拌的步骤1中间体(30.0g,143.3mmol)的THF(100ml)溶液中加入1N氢氧化钠(300ml),将该混合物于40℃搅拌20小时。将反应混合物冷却至0℃,将其用1N盐酸酸化至pH3.5。将混合物用二氯甲烷萃取(3×200ml),合并的萃取物用水(2×300ml)、盐水(300ml)洗涤,干燥(Na2SO4)。减压蒸发溶剂得到31.5g产物,为白色固体;IR(KBr)3408,3222,2982,1724,1681,1504,1392cm‑1;1H NMR(CDCl3,300MHz)δ1.45(s,9H),1.87‑2.03(m,1H),2.37‑2.60(m,1H),3.49(brs,1H),4.60(brs,1H),4.49(brs,1H),5.90(brs,2H),9.01(brs,1H)。
在异丙醇和乙醇混合物中,采用(R)‑(+)‑1‑苯基乙基胺将顺式‑(±)‑4‑N‑BOC‑氨基环戊‑2‑烯‑1‑甲酸光学拆分制备(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸。
参考文献
[1] [中国发明] CN201410747767.0 新的三环化合物
[2] PCT Int. Appl., 2006040625, 20 Apr 2006
欢迎您浏览更多关于(-)-(1S,4R)-N-叔丁氧羰基-4-氨基环戊-2-烯-1-甲酸的相关新闻资讯信息