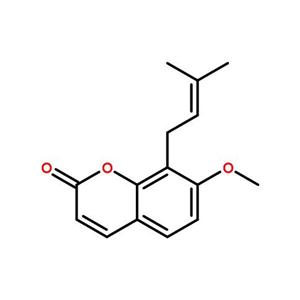
蛇床子素A−C,三种蛇床子素杂化二聚体的结构鉴定和半合成
发布日期:2021/2/18 11:22:37
文章介绍

从蛇床子中分离得到3对外消旋二聚体,即(±)-蛇床子素A−C(1−3)。它们代表了香豆素骨架新的杂化-二聚体模式,其末端是戊烯基手性碳。用电子圆二色谱(ECD)测定了对映体的绝对构型。为深入研究其生物活性,合成了(±)-蛇床子素A−C(1−3)。外消旋混合物(±)-1对单纯疱疹病毒1型(IC50为1.23μM)比其光学纯对映体有更强的抗病毒活性。
背景介绍
蛇床子是一年生群居草本植物,种植于越南、中国、日本和俄罗斯。果实被用作治疗哮喘、咳嗽、真菌感染和心律失常。研究表明,该植物中的化学成分具有多种活性。例如,蛇床子素是从蒙尼埃果实中分离出来的香豆素化合物,具有抗乙型肝炎病毒、抗炎、抗糖尿病和抗肿瘤活性。
数据分析
对该植物的进一步研究得到3对对映体二聚体:(±)-蛇床子素A−C(1−3),它们代表了香豆素−黄酮醇、香豆素−苯并呋喃和香豆素−色酮3种新型杂化二聚体,它们具有罕见的戊烯基末端手性碳。蛇床子素A−C在结构上具有相同的香豆素部分,只有一个(C-11”)手性中心,表明它们来源于蛇床子素的共同生物合成前体。在此,我们描述了(±)-蛇床子素A−C(1−3,图1)的分离、结构鉴定、手性分离、半合成和抗病毒活性。
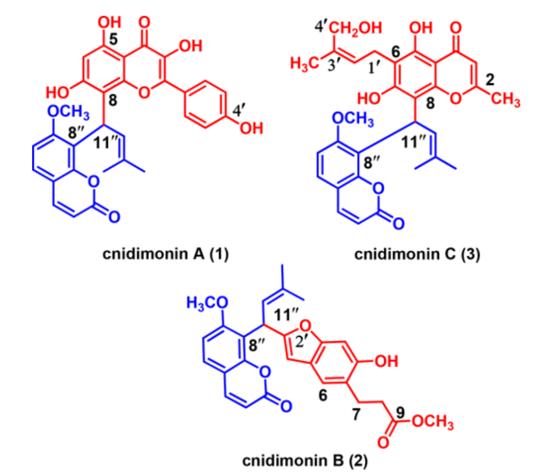
图1.(±)-cnidimonins A - C的结构
蛇床子素A(1)为黄色粉末,质谱结合NMR数据确定分子式C30H24O9。红外光谱有羟基(3262 cm−1)、羰基(1717,1649 cm−1)和芳香族基团(160 1,1512 cm−1)的存在。1HNMR显示两对AB型双重态δH7.94,6.21(每对1H,J=9.6 Hz,H-4”,H-3”);δH7.51,6.97(每对1H,J=8.4 Hz,H-5”,H-6”)以及一个甲氧基(δH3.62,3H,s)的信号,表明存在一个7甲氧基-8-取代香豆素核。根据δH6.01,6.10(每个1H,d,J=9.6 Hz,H-11”,12”)和两个甲基(δH1.63,1.57,每个3H,s)的1HNMR信号确定戊烯基的存在,对应于δC31.0,125.3,129.3,17.5,25.4的13CNMR信号,这由H3-15”/C-12”,C-13”;H3-14”/C-13” H-11”/C-12”和C-13”的HMBC证实。此外,δH6.12(1H,s)上剩余的芳香单重态以及四个属于对位取代苯基的质子被指定为4’,5,7-三羟基黄酮醇在C-6或C-8取代。在HMBC实验(图2)中,根据H-11与C-7(−C161.7)、C-8(δC107.3)和C-9(δC154.5)的HMBC关联,推测戊烯基团通过C-11”δC-8”连接到山奈酚部分。此外,观察到的H-11”与C-7”(−C160.1)、C-8”(δC119.4)和C-9”(δC152.5)的HMBC相关性表明戊烯基通过C11”−C-8”与香豆素部分的连接。因此,1的平面结构如图一所示。尽管在C-11”上存在一个立体中心,但1的旋光度接近于零,ECD光谱未观察到Cotton效应,表明1是外消旋混合物。随后,手性柱拆分得到等量 (+)-蛇床子素A[(+)-1]和(−)-蛇床子素A[(−)-1]。(+)-1和(−)-1的ECD显示出相反的Cotton效应,证实了对映体关系。通过比较实验和计算的电子捕获光谱,确定了(+)-1和(−)-1的绝对构型。如图3所示,(11”R)-1b和(11”S)-1a的计算结果分别与(−)-1和(+)-1的实验结果一致。据此确定对映体的绝对构型为(+)-(11”S)-1和(−)-(11”R-1。

图2.化合物1的1H−1H COSY和HMBC相关性
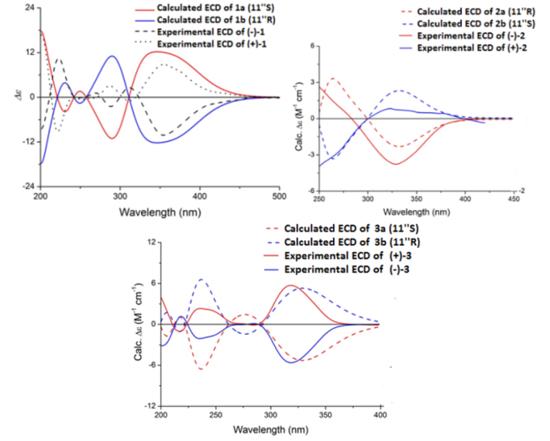
图3.化合物(+)1 /(−)1、(+)2 /(−)2、(+)3/(−)3的ECD光谱
蛇床子素B(2)为白色无定形粉末。质谱分析分子式为C27H26O7。红外光谱表明,2含有羟基(3329 cm−1)、羰基(1732 cm−1)、芳香族基团(1605、1460 cm−1)。1和2的NMR数据的比较,2的结构应该含有蛇床子素部分。化合物2的13CNMR显示27个碳共振峰。除了蛇床子素部分,13CNMR数据显示存在一个羰基碳,六个来自苯环的芳香碳,两个烯烃,两个亚甲基和一个甲氧基。通过H-1’/C-4、C-5和H-6/C-1’的HMBC相关性证实。结合不饱和度,证实存在苯并呋喃,H-1’/C-4、C-5和H-6/C-1’的HMBC相关性进一步证实。此外,COSY和HSQC谱上的耦合体系由位于δH2.87(2H,t,J=7.5HZ,15.0HZ,H-7)和δH2.57(2H,t,J=7.5HZ,15.0HzH-8)的两个亚甲基组成。通过H2-7/C-9的HMBC关联验证了C7−C9单元的存在。此外,通过从H-7到C-1(−C123.8)、C-2(δC153.2)和C-6(δC121.2)的HMBC相关,确定C7−C9单元附着在C-1到C-7上(图4)。通过δH5.73(H11”)处的甲基质子与C-1’(δC102.7)、C-2’(δC158.0)和C-8”(δC 117.3)的HMBC关联,建立了蛇床子素部分和苯并呋喃部分通过C-11”-C-2‘的连接。因此,建立了2的平面结构,如图1所示。与1相比,2在C-11”也有立体中心。手性拆分得到(+)-蛇床子素B[(+)-2]和(−)-蛇床子素B[(−)-2]。ECD计算确定了各对映体的绝对构型。如图3所示,(−)-2的绝对构型指定为11”R,(+)-2的绝对构型指定为11”S。

图4.化合物2的1H - 1H COSY和HMBC相关
蛇床子素C(3)纯化为白色粉末。由质谱检测分子式为C30H30O8。红外光谱含有羟基(3401cm−1),羰基(1729 cm−1),芳香族基团(1604 1495cm−1)。NMR数据分析表明,3与1和2具有相同的蛇床子素部分。除蛇床子素部分外,13C NMR谱显示15个碳共振谱归因于一个羰基碳、六个苯环芳烃碳、四个烯烃碳、一个亚甲基、两个甲基和一个羟甲基。3的NMR数据显示了与6-取代的5,7-二羟基-2-甲基色酮环的存在,通过相关文献数据比较证实。此外,H3-5’/C-2’,C-3’,C-4’;H2-4’/C-2’和H2-1’/C-5,C-6,C-7的HMBC关联证实戊烯基的存在及其在C-6的位置(图5)。δH6.05(H-11“)与C-7(δC162.1)、C-8(δC108.3)和C-9(δC155.7)的关键HMBC关联表明,蛇床子素部分通过C-11”−C-8与色酮部分相连。同时,根据H-2’与H3-5’和H-1’a,H2-4’与H-1b的NOE关联,对C-2’/C-3’烯烃为Z构型(图5)。因此,3的平面结构如图1所示。3是外消旋体。随后,手性拆分得到 (+)-蛇床子素C[(+)-3]和(−)-蛇床子素C[(−)-3]。通过ECD光谱与实验光谱的比较,确定了(+)-3和(−)-3的绝对构型。根据上述证据,明确地确定了(+)-3(11”R)和(−)-3(11”S)的绝对立体化学,如图3所示。

图5.化合物3的1H−1H COSY, HMBC和NOE相关
蛇床子素A−C的结构新颖,但由于量少不能研究其活性,因此对蛇床子素进行了合成。实现了蛇床子素A−C的高效合成。这些结构的一个共同特征是都含有相同的7部分,这简化了逆合成分析和8,11,15的合成策略,特别是8(山萘酚)是可以买到的,所以提出7与8,11,15相结合的合成策略。
蛇床子素4是从蒙尼埃中分离得到的。用AD-MIX-β对4进行双羟基化反应,在室温下反应12h,高产率地得到5。5与CDI后续反应得到环碳酸酯6,它通过与DBU在甲苯中120°C反应12h而转化为关键中间体7(方案1)。以市售补骨脂素9,11为起始原料,经甲醇水解和镁粉还原两步反应,产率可达41%(方案2)。
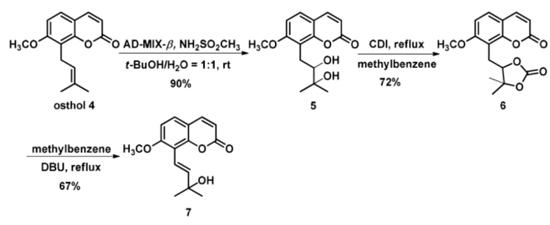
方案1.化合物7的合成路线

方案2.化合物11的合成路线
12与戊烯基溴发生烷基化反应得到已知化合物13,20,在95%乙醇溶液中用二氧化硒氧化得到14。关键中间体15可以由14分两步通过吡啶中的乙酸酐乙酰化和NaH的羟醛缩合反应(方案3)来构建。有了7、8、11和15,我们接下来将重点放在它们的耦合上。在Nafion50存在下,7与8、11和15 MeOH中室温缩合12h,得到外消旋二聚体(±)-1−3,产率分别为15%、12%和10%(方案4)。1−3的光谱数据与天然的蛇床子素A−C一致。合成的外消旋体1−3用CHIRALPAK AD-H色谱柱分离得到光学纯的对映体。

方案3.化合物15的合成路线

方案4.(±)-cnidimonins A-C的合成
蛇床子素A−C及其合成外消旋混合物进行了抗病毒活性试验(表1)。各对映体的量(Ee)≥99%。以无环鸟苷为阳性对照,IC50值为0.41μM。外消旋混合物(±)-1具有较强的抗单纯疱疹病毒-1活性,IC50值为1.23μM。纯对映体(+)-1和(−)-1对单纯疱疹病毒1型的抑制活性IC50(分别为6.41和3.70μM)弱于相应的外消旋混合物(±)-1。(+)-2具有中等活性,IC50值为11.11μM。结果表明,(+)-1和(−)-1可能存在协同抗单纯疱疹病毒的作用。

表1. HSV-1的抗病毒活性和化合物对Vero细胞的毒性
蛇床子素A−C代表了一个新的骨架,它是由结构不同的单元及罕见的戊烯基手性碳,通过香豆素独特的杂化-二聚体形成的。为了深入研究它们的生物活性,实现了蛇床子素A−C的高效合成。外消旋混合物(±)-1显示出比相应的纯对映体更强的抗病毒活性,表明存在协同效应,这可能为开发抗病毒药物的新的先导配体提供一些启示。同时,还需要进一步的研究。
原文信息
本文于2017年8月31日在线发表于Organic Letters。作者为苏芳宜,通讯作者为屈晶、庾石山,通讯单位为中国医学科学院、北京协和医学院药物研究所。