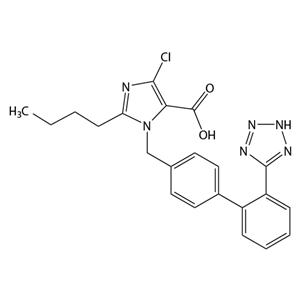
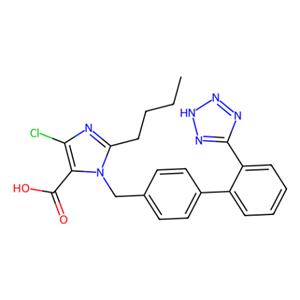
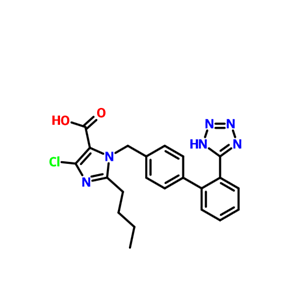
氯沙坦:第一个ARB抗高血压药物
发布日期:2021/1/25 14:30:12
▲ 图2 动脉血压与血液循环
人体调控血压的生理机制十分复杂,很多细节我们仍然不清楚。根据已有的讯息,科学家们已经开发出了各种有用的降血压药物。人体调控血压的一个重要系统是肾素-血管紧张素-醛固酮系统(Renin-angiotensin-aldosterone-system, RAAS),它已成为药物开发的焦点。先打个简单比方吧:用个水气球类比我们的动脉,里面的水好比脉管中的血液,气球壁好比血管壁。有两点因素可以控制水气球内的压力。其一,往气球里加水,压力会增加;反之,把里面的水倒出来,压力就会减小;其二,不让气球膨大,比如用外力压缩气球,里面的压力会增大;反之,气球在放松的状况下,里面压力会减小。RAAS从血管紧张肽原(angiotensinogen)开始,这个蛋白由452个氨基酸残基组成,其中的头10个氨基酸残基会被肾素(renin)催化剪切形成血管紧张素I(angiotensinI, Ang I),而这个Ang I会被血管紧张素转化酶(angiotensin conversion enzyme,ACE)催化转化成血管紧张素II(angiotensinII,Ang II)。血管紧张素通过与它的受体结合,起到很多生理作用,其中很重要的两条都与血压调控有关。一是刺激肾上腺分泌一种荷尔蒙-醛固酮,这个醛固酮能滞留体内的水分与钠离子。这好比往水气球中加水一般,导致血压增加。二是刺激血管壁中平滑肌的收缩,这也会导致压力增加。总的来说,Ang II与它的受体结合,导致血压增加。这个系统里有三个可以做药的靶点来调控它的功能,降低血压:抑制肾素或者ACE,减少AngII的形成;或者阻止Ang II与它的受体的结合,使得Ang II无法施展它的生理功能。如今,这些概念都已经被实现,这三类药物都已经被开发应用,上市造福高血压患者了。
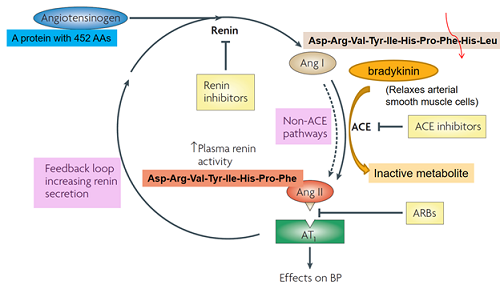
▲ 图3 RAAS调节血压
1981年4月6日,美国食品药物局(FDA)批准了施贵宝(BMS)的血管紧张素转换酶抑制剂(ACE inhibitor,ACEi)药物卡普托利(captopril)上市,治疗高血压和各种心血管病的方式从此发生了巨大变化,而后全世界成千上万的病人因为这个药物及其后续的同类药物而受益。这个药物的重要性有二:其一,它是治疗高血压的新型药物,是血管紧张素转换酶抑制剂中的首创药物;其二,这个药物是通过合理药物设计(rational drug design)开发出来的被批准临床应用首批药物之一。合理药物设计出现于1950s,这个领域的开拓者们包括James Black、Gertrude Elion和GeorgeHitchings,他们构想出了药物设计与治疗的原理,因为这些工作荣获了1988年的诺贝尔生理学奖。
卡托普利及其同类的血管紧张素转换酶抑制剂治疗高血压对有些病人很有效,然而对有些病人却会导致干咳或血管水肿等不良反应。对RAAS更多的研究发现,从Ang I到Ang II,除了ACE以外还有其他酶催化转化这个过程,ACEi并不能完全挡住Ang II的形成;ACE也不是一个专一催化这一过程的酶,它还可以催化另一种蛋白的降解,这个过程可能与某些副作用有关。
Ang II的受体(Angiotensin II receptor, ATR,AT受体),是一种经典的G-蛋白偶联受体(GPCR),包含七个跨膜的a-螺旋,它们形成一个中间有孔的圆筒状结构,Ang II结合在中间这个孔里,活化受体,引发各种生理作用。当时还没有这个受体的晶体结构。GPCR的结构研究曾经荣获2012年的诺贝尔化学奖,一旦有个新的GPCR晶体结构解析出来,往往可以在顶级的科学期刊比如“科学”或者“自然”上发表论文。Ang II则是一个包含八个氨基酸残基的多肽,它的组成相对容易鉴定出来。起初,科学家想着模仿Ang II的结构,筛选了各种多肽,寻找可以阻断Ang II与受体结合的药物。其中最重要最有代表性的是沙拉新(saralasin),它与Ang II只有三个氨基酸残基不一样,是AngII的直接结构类似物。大鼠体内证实了它是一种AT受体拮抗剂;静脉注射入人体时,它可以降低血压。遗憾的是因为它是一种多肽,在体内很快被降解,药效不持久,口服生物利用度低,并不适宜作为药物。而且沙拉新还有部分激动剂活性。
1980s初期,杜邦公司(DuPont)成立了自己的药物开发部门,也在寻找AT受体拮抗剂。他们筛选了小分子化合物库中的上万个化合物,也没有找到有用的化合物。1982年底,日本武田(Takeda)公司公布了两篇专利申请,报道了一组苄基咪唑醋酸衍生物能选择性作用于AT1R(ATR的一种亚型),是一种竞争性拮抗剂,而且没有部分激动剂活性。但是这些化合物的活性很低,而且口服生物利用度有限。当时AT受体的晶体结构还没有解析出来,根据核磁共振研究Ang II在水中的构象得来的AngII的空间结构信息,杜邦的科学家计算建模,然后将武田的先导化合物S-8307与Ang II的模型重叠比较,认为在小分子先导化合物中苄基的对位额外引入一个酸性集团可以提高结合活性(图4)。
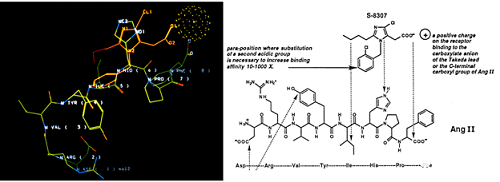
▲ 图4 S-8307与Ang II 的结构叠合启示引入另一个酸性基团可以提高活性
果然,得到的4-羧基衍生物EXP-6155的结合活性比S-8307提高了30多倍。将4-羧基替换成2-羧基苯甲酰胺基团得到EXP6803,结合活性进一步被提高了近10倍,然而化合物仍然只能通过静脉注射达到一定药效。在这第二个苯环上酰胺的邻位引入取代将化合物结合活性再次提高,达到了18nM,可惜的是体内活性并没有增加。杜邦的科学家认为两个芳环间的酰胺键脂溶性太低,将其去掉,让两个苯环直接相连,得到的EXP7711分子对AT1的结合活性虽然降低了,分子有了较好的口服生物利用度。苯环上的羧基最后被更加亲脂的生物电子等排体四氮唑替换掉了以进一步增加口服生物利用度和药效,最后于1986年得到了DuP-753,即后来于1995年被批上市治疗高血压的氯沙坦这个药物的API。氯沙坦钾成了个成功的Ang II受体拮抗剂药物(ARB),已成为高血压治疗市场的里程碑。
在氯沙坦之前,没有任何一个已上市或者在开发的药物中含有这个酸性的四氮唑基团,对这类化合物在动物尤其是在人上的毒性或安全性数据很少乃至几乎没有。氯沙坦的动物与临床试验证明了其安全性,四氮唑在体内也没有降解成有毒的副产物。四氮唑对光敏感,但是氯沙坦的化学稳定性很好,并没有生成腈或消除N2的化合物。从此药学界将稳定且无毒的四氮唑基团纳入了常备药化基团“武器库”,后来更多公司接连开发了各自的沙坦类药物,大部分包含了四氮唑这一重要基团。
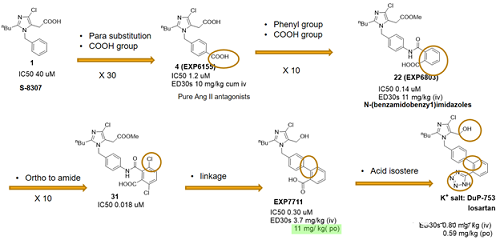
图5 杜邦通过理性设计与药化经验优化改造得到了氯沙坦
除了四氮唑,为了替换联苯上的羧基,杜邦的药化家们羧基的各种生物电子等排体做了非常详尽的SAR研究。以下是酰胺类等排体及对应的活性数据,还做了唑类等排体及测试活性等。关于羧基的生物电子等排体的信息,可以参阅微文药物分子设计中的生物电子等排体(IV)。
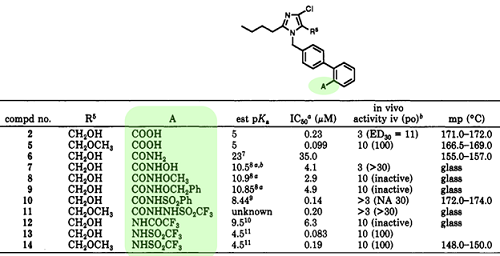
▲ 图6 羧基用电子等排体酰胺替换后的活性数据
(号外:随着晶体学的进展,2015年,科学家们通过运用连续飞秒晶体技术,解析了人源AT1受体与小分子ZD7155的共晶结构,并以此建模对接揭示了临床用的沙坦类降高血压药物包括氯沙坦靶向AT1受体的结合模式。)