ChemicalBook CAS数据库列表 碳酸钠
碳酸钠
- CAS号:497-19-8
- 英文名:Sodium carbonate
- 中文名:碳酸钠
- CBNumber:CB9853672
- 分子式:CH2O3.2Na
- 分子量:105.99
- MOL File:497-19-8.mol
碳酸钠化学性质
- 熔点 :851 °C (lit.)
- 沸点 :1600°C
- 密度 :2.53
- 折射率 :1.535
- 储存条件 :15-25°C
- 溶解度 :H2O: 1 M at 20 °C, clear, colorless
- 形态 :Solid
- 比重 :2.532
- 颜色 :White
- PH值 :10.52(1 mM solution);10.97(10 mM solution);11.26(100 mM solution);
- 气味 (Odor) :at 100.00?%. odorless
- 酸度系数(pKa) :(1) 6.37, (2) 10.25 (carbonic (at 25℃)
- 水溶解性 :22 g/100 mL (20 ºC)
- 敏感性 :Hygroscopic
- 最大波长(λmax) :λ: 260 nm Amax: 0.01
λ: 280 nm Amax: 0.01 - Merck :14,8596
- BRN :4154566
- 介电常数 :5.3(Ambient)
- 稳定性 :Stable. Incompatible with powdered alkaline earth metals, aluminium, organic nitro compounds, fluorine, alkali metals, nonmetallic oxides, concentrated sulfuric acid, oxides of phosphorus.
- InChIKey :CDBYLPFSWZWCQE-UHFFFAOYSA-L
- CAS 数据库 :497-19-8(CAS DataBase Reference)
- NIST化学物质信息 :Sodium carbonate(497-19-8)
- EPA化学物质信息 :Sodium carbonate (497-19-8)
安全信息
- 危险品标志 :Xn,Xi
- 危险类别码 :32-36-51/53-36/37/38-41-37/38
- 安全说明 :36/37-26-22-36-39
- WGK Germany :2
- RTECS号 :XN6476000
- F :3
- TSCA :Yes
- 海关编码 :28362000
- 毒害物质数据 :497-19-8(Hazardous Substances Data)
- 毒性 :LD50 orally in Rabbit: 4090 mg/kg
碳酸钠 MSDS
Sodium carbonate
碳酸钠
碳酸钠性质、用途与生产工艺
- 概述 碳酸钠化学式为Na2CO3,俗名纯碱、苏打、碱灰、洗涤碱,普通情况下为白色粉末,为强电解质。密度为2.532g/cm3,熔点为851°C,易溶于水,具有盐的通性,是一种弱酸盐,微溶于无水乙醇,不溶于丙醇,溶于水后发生水解反应,使溶液显碱性,有一定的腐蚀性,能与酸进行中和反应,生成相应的盐并放出二氧化碳。高温下可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强 ,很容易结成硬块,在高温下也不分解。碳酸钠与水生成Na2CO3·10H2O,Na2CO3·7H2O,Na2CO3·H2O三种水合物,其中Na2CO3·10H2O最为稳定,且溶于水的溶解热非常小。多应用于照相行业,其商品名称为碳氧。Na2CO3·10H2O又称晶碱,在干燥的空气中易风化,以前晶碱常用于家庭洗涤和洗羊毛,故又称“洗濯碱”。过去,我国民间习惯使用既能洗衣又能发面的“块碱”,那是用纯碱加大量水搅拌制成的(另加有一些小苏打(NaHCO3),其含水量在50%以上。碳酸钠溶于水时呈吸热反应,在空气中易风化。Na2CO3·7H2O不稳定,仅在32.5~36℃范围内才能从碳酸钠饱和溶液中析出。碳酸钠是弱酸强碱盐(纯碱是盐,不是碱,只是溶液显强碱性)。用化学方法制出的Na2CO3比天然碱纯净,人们因此称它为“纯碱”。
-
水中溶解度
不同温度(℃)时每100克水中的最大溶解克数:
7.0g/0℃;12.2g/10℃;21.8g/20℃;29.4g/25℃;39.7g/30℃;
48.8g/40℃;47.3g/50℃;46.4g/60℃;46.2g/70℃;45.8g/80℃;
45.7g/90℃;45.5g/100℃; -
和碳酸氢钠的鉴别
将这两种物质放在两支试管中加热,并将试管的另一端通入澄清的石灰水,如果观察到澄清的石灰水变浑浊,那么这个试管中的物质是碳酸氢钠,而没有观察到澄清石灰水变浑浊的试管中的物质是碳酸钠。
原理:2NaHCO3=Na2CO3+H2O+CO2↑(条件是加热),Na2CO3加热不分解. - 毒性 ADI(日容许摄入量)不作限制性规定(FAO/WHO1985年)。LD50(半数致死量)约6 g/kg(小鼠经口)。
- 毒性 纯碱粉尘对皮肤、呼吸道和眼睛有刺激作用。长时间接触纯碱溶液可能出现湿疹、皮炎等。其浓溶液可引起烧伤、坏死,以至角膜浑浊。空气中纯碱粉尘最高容许浓度为2mg/m3。操作人员应穿戴工作服、门罩、手套、长统靴等劳保用品,以保护呼吸器官和皮肤。
-
用途
在生产生活中,碳酸钠被用于制作面点,制取氢氧化钠等,或作为多种洗涤剂的配方。水的净化用它来做软化剂。
在工业用纯碱中,主要是轻工、建材、化学工业,约占2/3;其次是冶金、纺织、石油、国防、医药及其它工业。玻璃工业是纯碱的最大消费部门,每吨玻璃消耗纯碱0.2吨。化学工业用于制水玻璃、重铬酸钠、硝酸钠、氟化钠、小苏打、硼砂、磷酸三钠等。冶金工业用作冶炼助熔剂、选矿用浮选剂,炼钢和炼锑用作脱硫剂。印染工业用作软水剂。制革工业用于原料皮的脱脂、中和铬鞣革和提高铬鞣液碱度。还用于生产合成洗涤剂添加剂三聚磷酸钠和其他磷酸钠盐等。食用级纯碱用于生产味精、面食等 -
食品添加剂最大允许使用量最大允许残留量标准
▼▲添加剂中文名称允许使用该种添加剂的食品中文名称添加剂功能最大允许使用量(g/kg)最大允许残留量(g/kg)碳酸钠食品食品工业用加工助剂/一般应在制成最后成品之前出去,有规定食品中残留量的除外碳酸钠糕点酸度调节剂按生产需要适量使用碳酸钠小麦粉制品酸度调节剂按生产需要适量使用
-
工业制备方法
由氨、二氧化碳和饱和食盐水为原料制得,称为联合制碱法,是中国化学家侯德榜在氨碱法的基础上改进而成,该法在世界博览会上获得金制奖章。在北美,由于有大量天然碳酸钠矿藏存在,用天然的碱人工加工精制是制取碳酸钠的主要手段。碳酸钠是化学及工业中的重要原材料。2003年,中国碳酸钠产量已经超过美国跃居世界第一。
在联合制碱法发明以前,氨碱法(亦称为索尔维制碱法)应用最为广泛。是比利时人欧内斯特·索尔维于1862年发明的。
反应分三个步骤进行:
1.NH3 + CO2 + H2O → NH4HCO3
2.NH4HCO3 + NaCl → NaHCO3 + NH4Cl
3.2NaHCO3 → Na2CO3 + CO2 + H2O
反应生成的CO2可以回收再用,而NH4Cl又可以与生石灰反应,产生NH3,重新作为原料使用:
2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
氨碱法使生产实现了连续性生产,食盐的利用率得到提高,产品质量纯净,因而被称为“纯碱”,但最大的优点还在于成本低廉。
1867年索尔维设厂制造的产品在巴黎世界博览会上获得铜制奖章,此法被正式命名为索尔维法。此时,纯碱的价格大大下降。消息传到英国,正在从事路布兰法制碱的英国哈琴森公司取得了两年独占索尔维法的权利。1873年哈琴森公司改组为卜内门公司,建立了大规模生产纯碱的工厂,后来,法、德、美等国相继建厂。这些国家发起组织索尔维公会,设计图纸只向会员国公开,对外绝对保守秘密。凡有改良或新发现,会员国之间彼此通气,并相约不申请专利,以防泄露。除了技术之外,营业也有限制,他们采取分区售货的办法,例如中国市场由英国卜内门公司独占。由于如此严密的组织方式,凡是不得索尔维公会特许权者,根本无从问津氨碱法生产详情。直至20世纪初,许多国家要想探索索尔维法奥秘的厂商,无不以失败而告终。直至有关专利告终,此制作方法才大白于世。
侯氏与索氏两法的区别:主要反应在对待氯化铵的态度上。索氏是加入生石灰发使氨逸出,而候氏是加入食盐使氯化铵结晶而出。 - 化学性质 无水碳酸钠的纯品是白色粉末或细粒。 易溶于水,水溶液呈强碱性。微溶于无水乙醇,不溶于丙酮。
- 用途 用作分析试剂,也用于制药工业和照相制版
- 用途 用于食品工业,作中和剂、膨松剂,如制造氨基酸、酱油和面制食品如馒头、面包等。还可配成碱水加入面食中,增加弹性和延展性。
- 用途 绝大部分用于工业,一小部分为民用。在工业用纯碱中,主要是轻工、建材、化学工业,约占2/3:其次是冶金、纺织、石油、国防、医药及其他工业。玻璃工业是纯碱的摄大消费部门,每吨玻璃消耗纯碱O.2t。化学工业用于制水玻璃、重铬酸钠、硝酸钠、氟化钠、小苏打、硼砂、磷酸三钠等。冶金工业用作冶炼助熔剂、选矿用浮选剂,炼钢和炼锑用作脱硫剂。印染工业用作软水剂。制革工业用于原料皮的脱脂、中和铬鞣革和提高铬鞣液碱度。还用于生产合成洗涤剂添加剂三聚磷酸钠和其他磷酸钠盐等。
- 用途 碳酸钠是基本化工原料之一,用途广泛,是玻璃、肥皂、洗涤剂、纺织、制革、香料、染料、药品等的重要原料。主要用于浮法玻璃、显像管玻壳、光学玻璃等。也可用于化工、冶金等其他部门。使用重质纯碱可以减少碱尘飞扬、降低原料消耗、改善劳动条件,还可提高产品质量,同时减轻碱粉对耐火材料的侵蚀作用,延长窑炉的使用寿命。
-
生产方法
有氨碱法、联碱法、天然碱加工等。
氨碱法主要反应如下:NaCl+NH3+CO2+H2O→NaHCO3+NH4Cl
2NaHCO3→Na2CO3+CO2+H2O
其工艺流程简述如下:原盐用水溶解,除钙、镁后制成精盐水(或称二次盐水,下同)。二次盐水经吸氨,制成NaCl浓度在89滴度以上,FNH3与Na+浓度之比为1.13~1.18的氨盐水。氧盐水冷却至35~38℃后送至碳化工段,与来自石灰窑和煅烧炉经压缩的二氧化碳进行反应,生成碳酸氢钠悬浮液,流至滤过工段,碳酸氧钠(重碱)结晶从悬浮液中分离出来,送至煅烧上段,在160℃左右煅烧分解,制得纯碱产品。过滤母液与来自石灰工段的石灰乳混合制成调和液,并在蒸馏塔中用蒸汽加热蒸出其中的氨,供盐水吸氨循环使用。
联碱法联合制碱法生产流程分为制碱过程(又称I过程)和制铵过程(又称Ⅱ过程),联产纯碱和氯化铵,母液则在两过程中构成封闭循环。
主要反应与氨碱法相同。其工艺流程简述如下:将原盐(氯化钠)用饱和盐水洗涤除去钙、镁杂质,再经粉碎、洗涤、稠厚、分离,制得符合规定纯度(含NaCl≥98%)、粒度(10~20网目)的洗盐,送至盐析结晶器。由盐析结晶器溢流的母液Ⅱ在吸氨器内吸收氨制成氨母液Ⅱ,经澄清后送入碳化塔内吸收二氧化碳(碳化)制成碳酸氢钠悬浮液,碳酸氢钠悬浮液经过滤,得到固体碳酸氢钠,再经煅烧即得到纯碱产品。
过滤重碱后的母液(母液I)经吸氨制成氨母液I,经换热器与母液Ⅱ换热,降温后送入冷析结晶器,通过外冷器与载冷体(卤水)或者与冷冻剂(液氨)直接进行热交换,在5~10℃条件下冷却析出部分氯化铵。冷析结晶器溢流液(半母液Ⅱ)流人盐析结晶器,加入洗盐再析出部分氯化铵。由冷析及盐析结晶器取出的氯化铵悬浮液经稠厚、分离,得到湿氯化铵,送干铵炉干燥即为氯化铵产品。盐析结晶器溢流液(母液Ⅱ)与氨母液l换热后经吸氨制成氨母液Ⅱ,再送至碳化塔制碱。如此连续循环,不断地生产出纯碱和氯化铵两种产品。
天然碱加工法
倍半碱流程此法是以倍半碱为原料生产纯碱的方法.美国部分天然碱加工厂采用。
矿石粉碎至20目(O.8mm)左右,送入溶解槽,用循环母液溶解制成饱和溶液,进入澄清桶澄清,其底流送增稠器,加水洗涤回收泥中的碱分,澄清桶溢流液经过滤送三效蒸发器蒸发,从第三效蒸发器取出的晶浆用泵送入稠厚器,再经离心脱水,得倍半碳酸钠滤饼,经煅烧即制得纯碱。
一水碳流程此法也是以倍半碱为原料生产纯碱的方法,其产品质量优于倍半碱流程,美国多数天然碱加工厂采用。
矿石粉碎至6 mm左右,送煅烧炉,在150℃左右煅烧,矿石大部分为粗纯碱,进人溶解槽,在略低于100℃条件下溶解,澄清后送人三效蒸发器,蒸浓后的悬浮碱液分离得到一水碳酸钠,送干燥器干燥即得重质纯碱。
碳酸化法该法是以天然碱卤为原料的生产方法,我国大布苏等地天然碱加工采用。
天然碱溶采或用水溶解后的碱卤经澄清、预热后通人二氧化碳进行碳酸化,再经过滤、煅烧即制得纯碱产品。20世纪80年代中期开发成功氨化碳化法,即将精制的碱卤先吸氮后碳化,此后工序同前。氨化碳化法与直接碳化法相比,钠利用率可由25%提高到65%~70%。
天然碱卤蒸发法用溶采天然碱矿或从碱湖挖掘的天然碱制得碱卤,经精制、分离、预热、蒸发、分离、煅烧即制得莺质纯碱。 -
生产方法
1.氨碱法
原盐(食盐)溶于水,加入适量的石灰乳以除镁,通入CO2以除钙。经净化的食盐水通入氨气进行吸氨,吸氨母液中再通入CO2进行碳化,析出碳酸氢钠,经过滤、煅烧得碳酸钠。母液中加入石灰乳,并将氨气蒸出供吸氨用。
NaCl+NH3+CO2+H2O→NaHCO3+NH4Cl
2NaHCO3→Na2CO3+CO2↑+H2O↑
2联碱法
将氨气通人盐析结晶的母液进行吸氨,吸氨母液再通人CO2进行碳化,析出碳酸氢钠结晶,经过滤、煅烧得纯碱。母液再进行吸氨,析出氯化铵结晶,过滤后再加入食盐,进一步析出氯化铵结晶。过滤后母液重新去吸氨,如此不断地循环。反应式与氨碱法相同。 -
生产方法
目前工业上以轻质纯碱为原料生产重质纯碱的方法有固相水合法、液相水合法和挤压法,以天然碱为原料有蒸发法和碳酸化法,后两种方法已在工业碳酸钠部分述及,故仅叙述以纯碱为原料的三种方法。
固相水合法 将高温轻质纯碱与 50~70℃的热水于90~97℃条件下进行水合反应,生成一水碳酸钠,于130~150℃进行煅烧,再经筛分,制得重质纯碱成品.其Na2CO3+H2O→Na2CO3·H2O
Na2CO3·H2O[△] →Na2CO3+H2O
液相水合法 高温轻质纯碱在100℃左右用水和循环母液溶解,制得饱和溶液并进行水合反应后,用泵送至结晶器.降温至80~90℃,生成一水碳酸钠悬浮液,经稠厚、分离,即制得重质纯碱成品。其反应式与固相水合法相同。
挤压法 来自碱仓的高温纯碱(150~160℃)在5000~7000 kg/cm2压力下挤压成厚约2 mm的坚硬薄片,再经粉碎、筛分,得到粒度适宜的重质纯碱成品.大粒返回破碎.小粒重新挤压,分别循环使用。 - 生产方法 目前我国均采用氨碱法或联碱法直接制造食用纯碱。在生产轻质纯碱过程中,要增加除砷和除重金属杂质的精制工序.其他工序参见工业碳酸钠。
-
生产方法
碳酸钠合成法将粗碳酸钠和碳酸氢钠经蒸汽溶解,沉降除杂后清液,通二氧化碳反应到一定浓度后,再经蒸馏、冷却、结晶即得倍半碳酸钠,其
Na2CO3+NaHCO3+2H2O→Na2CO3·NaHCO3·2H2O
天然碱法 以天然碱为原料经蒸汽溶解,澄清除杂,清液含碳酸钠、碳酸氢钠及硫酸钠等组分,经窑气碳化使部分Na2CO3重碳酸化为NaHCO3,在60℃蒸发析出生成相应的复合物,分离制得倍半碳酸钠成品。母液再蒸发即可析出芒硝碱。其
3Na2CO3+5H2O+CO2→2(Na2CO3·NaHC03·2H2O) - 类别 有毒物品
- 毒性分级 中毒
- 急性毒性 口服- 大鼠 LD50 4090 毫克/ 公斤; 口服- 小鼠 LD50: 6600 毫克/公斤
- 刺激数据 皮肤-兔 500 毫克/ 24小时 轻度; 眼睛- 兔 100 毫克/ 24小时 中度
- 爆炸物危险特性 有腐蚀性
- 可燃性危险特性 不可燃烧; 火场产生有毒氧化钠烟雾;
- 储运特性 库房低温, 通风, 干燥
- 灭火剂 水, 二氧化碳, 干粉, 砂土
碳酸钠上下游产品信息
上游原料
下游产品
- B-丁内酯 活性黑KN-BN 钙芒硝 活性黑KN-B 2-吡啶基偕胺肟 1-溴-2-氯乙烷 聚阴离子纤维素 硼肥 6-羟基-2-苯基-3-哒酮 α-甲基肉桂醛 4-吡啶基偕胺肟 食用酸式磷酸铝钠 邻硝基苯甲醇 甲基硫氧嘧啶 醋纤嘴棒增塑剂 酒石酸钠 2,4-二氨基-1,3,5-三嗪 碳酸银 醋酸辛酯 4-乙氧羰基-1-甲基-5-吡唑磺酰氨基甲酸乙酯 异丙氧基乙醇 防水剂 AC 表面活性剂 CSL 尼泊金异丙酯 2-氯-4-甲基嘧啶 食用碱式磷酸铝钠 1,3-二溴-2-丙醇 噻吩-2-胺肟 3-吡啶基偕胺肟 叔丁基异氰酸酯 耐晒孔雀蓝色淀 磺胺二甲嘧啶 双链酶 二水合磷酸二氢钠 苯甲酰胺肟 氟化铝钾 次磷酸钠 6-甲基-4-羟基-2-甲硫基嘧啶 苯系列有机废气净化催化剂 靛玉红
- 更新日期:2024/11/11
- 产品编号:XW49719901
- 产品名称:碳酸钠溶液
- CAS编号:497-19-8
- 包装:500ML
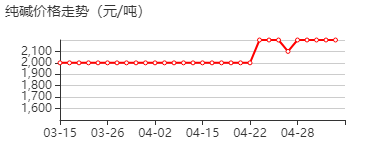
- 价格:315元
- 更新日期:2024/11/08
- 产品编号:L13098
- 产品名称:碳酸钠, 98% Sodium carbonate, 98%
- CAS编号:497-19-8
- 包装:500g
- 价格:398元
碳酸钠生产厂家
- 阿根廷 3 阿拉伯联合酋长国 3 阿曼 1 埃及 3 爱尔兰 1 奥地利 3 澳大利亚 8 巴基斯坦 1 巴西 6 比利时 12 波兰 3 丹麦 2 德国 32 俄罗斯 4 法国 10 哥伦比亚 1 哥斯达黎加 1 韩国 5 荷兰 6 加拿大 14 捷克共和国 5 卡塔尔 1 肯尼亚 1 黎巴嫩 2 马来西亚 5 美国 172 孟加拉国 1 墨西哥 15 南非 3 欧洲 2 日本 22 瑞士 2 斯洛伐克 2 泰国 3 土耳其 1 乌克兰 1 西班牙 9 希腊 2 新加坡 6 新西兰 1 匈牙利 1 意大利 7 印度 321 印度尼西亚 1 英国 44 约旦 2 智利 2 中国 734 全球 1487 碳酸钠国内生产厂家
- 公司名称:DAEMYUNG CHEMICAL. ALL RIGHTS RESERVED
- 联系电话:+86-02-462-3857 +86-02-462-3857
- 电子邮件:to@dmchem.co.kr
- 国家:韩国
- 产品数:4
- 优势度:58
- 公司名称:OCI Company Ltd.
- 联系电话:--
- 电子邮件:FSB@oci.co.kr
- 国家:韩国
- 产品数:17
- 优势度:58
- 公司名称:UNID Global Corporation (OCI Corporation)
- 联系电话:--
- 电子邮件:william@unidcorp.co.kr
- 国家:韩国
- 产品数:62
- 优势度:58
- 公司名称:Rifa Co., Ltd.
- 联系电话:--
- 电子邮件:anghyojin@rifa.co.kr
- 国家:韩国
- 产品数:43
- 优势度:58
- 公司名称:CHEMICAL LAND21
- 联系电话:--
- 电子邮件:sales21@chemicalland21.com
- 国家:韩国
- 产品数:6303
- 优势度:74
497-19-8, 碳酸钠相关搜索: