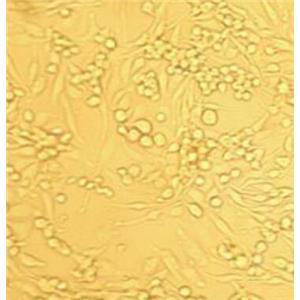
大鼠肠微血管内皮细胞的应用
发布日期:2020/10/18 17:56:53
背景[1-7]
大鼠肠微血管内皮细胞分离自肠道组织;肠道指的是从胃幽门至肛门的消化管。肠是消化管中最长的一段,也是功能最重要的一段。哺乳动物的肠包括小肠、大肠和直肠3大段。大量的消化作用和几乎全部消化产物的吸收都是在小肠内进行的,大肠主要浓缩食物残渣,形成粪便,再通过直肠经肛门排出体外。
肠道堪称身体最劳累的器官——每天不停地消化、吸收食物,以提供足够的养分,其实它的功能还远不止此—它还是机体内的微生态系统。微血管是极细微的血管,管径平均为6-9μm,连于动、静脉之间,互相连接成网状。微血管壁薄,管径较小,血流很慢,通透性大。其功能是利于血液与组织之间进行物质交换。其管壁主要由一层内皮细胞构成,在内皮外面有一薄层结缔组织。另外还常可见到一种扁而有突起的细胞贴在微血管的管壁外面,称为周细胞。大鼠肠微血管内皮细胞采用胰蛋白酶-胶原酶联合消化法结合差速贴壁法、并通过内皮细胞专用培养基培养筛选制备而来,细胞总量约为5×10^5cells/瓶;细胞经CD31/vWF免疫荧光鉴定,纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。
应用[8][9]
用于玉米花粉多糖对大鼠肠绒毛微血管内皮细胞几种免疫相关因子的影响
玉米花粉多糖(PAM)的免疫增强作用机制,同时借此探讨机体免疫调节系统的基本工作模式。基本方法是监测大鼠肠绒毛微血管内皮细胞(REC)培养物中受一定浓度的PAM刺激后分泌免疫相关因子NO、IL-6、ET-1的浓度变化。首先提取PAM并进行纯化和含量测定。参考植物多糖提取的一般工艺进行改进,直接使用乙醇回流,然后再使用水提醇沉法。最后通过葡聚糖凝胶柱纯化,收集Molish反应阳性部分干燥备用。其次培养REC并进行纯化,用间接免疫荧光法等鉴定均显示阳性,由此确认得到内皮细胞。参考哺乳动物正常血糖水平,设计PAM原始工作浓度为100μg/ml,约为正常血糖水平的600~1000分之一,实际作用浓度在4~8μg/ml。当细胞层生长达80%时,消化并且收获细胞,做细胞计数,稀释到1×10~5/ml备用。取新细胞培养板,按照每孔0.5ml进行接种,继续培养。将预先升至室温的PAM溶液按照20μl的设计加入到各组细胞培养孔中。
按照设计时间取样,经过3000rpm×5min离心,收取上清液冷冻存放备检。对样品中的一氧化氮采用硝酸还原酶法检测。结果试验组中的NO含量在可观察到的7小时以内均明显高于对照组,而且呈现剂量依赖性,但随时间延长,NO含量有逐渐下降的趋势。表明PAM的刺激导致REC分泌NO突然增加,然后逐渐减少;即PAM对REC的作用之一是导致REC分泌NO含量显著增加。对样品中的IL-6采用试剂盒ELISA法测定。试验组仍然明显高于对照组,且呈现相同的变化规律。对样品中ET-1采用试剂盒ELISA法测定。从第48小时后试验组均比对照组高,随时间延长呈明显上升趋势。综合分析试验结果,PAM刺激初期,REC呈爆发式分泌大量NO后逐渐减少NO分泌量;然后分泌较多的IL-6;在持续大约48小时左右,开始增加分泌ET-1并逐渐加强。
从这些细胞因子的生理作用分析,受PAM刺激后,首先表现为血管壁的扩张,细胞间隙加大,促进炎性反应发生;然后表现为血管壁的收缩,控制漏出液,减轻炎性反应程度,即具有免疫增强作用的PAM接触到REC时会使REC分泌NO、ET-1等细胞因子情况发生变化。在体内,PAM产生刺激作用时可能伴随有血管壁自身的舒张与收缩运动。这说明PAM的免疫增强作用机制在于首先对REC分泌功能的调节,由此可以猜想内皮细胞在免疫调节中很可能处于某种关键地位。
参考文献
[1]Human macrovascular endothelial cells:Optimization of culture conditions[J].Thomas T.Terramani,Darwin Eton,Phong A.Bui,Ying Wang,Fred A.Weaver,Hong Yu.In Vitro Cellular&Developmental Biology-Animal.1999(2)
[2]Optimization of culture conditions for human corneal endothelial cells[J].Katrin Engelmann,Peter Friedl.In Vitro Cellular&Developmental Biology.1989(11)
[3]Isolation and culture of cells derived from human cerebral microvessels[J].Harry V.Vinters,Susan Reave,Penny Costello,John P.Girvin,Steven A.Moore.Cell and Tissue Research.1987(3)
[4]Optimized medium for clonal growth of human microvascular endothelial cells with minimal serum[J].Ann Knedler,Richard G.Ham.In Vitro Cellular&Developmental Biology.1987(7)
[5]Primary culture of capillary endothelium from rat brain[J].Phillip D.Bowman,A.Lorris Betz,Diane aR,Jerry S.Wolinsky,Jack B.Penney,Richard R.Shivers,Gary W.Goldstein.In Vitro.1981(4)
[6]Human vascular endothelial cells in culture,growth and DNA synthesis.Gimbrone M A,Cotrans R S,Folkman J.The Journal of Cell Biology.1974
[7]Repression of lipopolysacharide biosynthesis in Escherichia coil by an antisense RNA of Acetobacter methanolocus phage Acml.Mamat U,Rietschel,Schmidt G,et al.Molecular Microbiology.1995
[8]Isolation and culture of pulmonary artery endothelial cells.Ryan M S,Clements E,Habliston D,et al.Tissue and Cell.1973
[9]刘易通.玉米花粉多糖对大鼠肠绒毛微血管内皮细胞几种免疫相关因子的影响[D].河北农业大学,2006.
欢迎您浏览更多关于大鼠肠微血管内皮细胞的相关新闻资讯信息