EHA101感受态细胞的应用
发布日期:2020/4/28 7:22:22
背景[1-6]
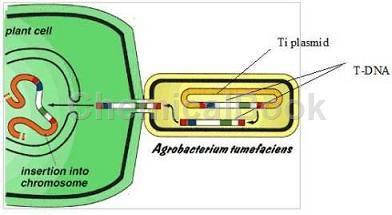
EHA101 Electro感受态细胞使用EHA101菌株为C58型背景制作,核基因中含有筛选标签——利福平抗性基因rif,为了便于转化操作,此菌株携带一无自身转运功能的胭脂碱型Ti质粒pEHA101(pTiBo542DT-DNA),此质粒含有vir基因(vir基因是T-DNA插入植物基因组必需的元件,pEHA101(pTiBo542DT-DNA)质粒自身的T-DNA转移功能被破坏,但可以帮助转入的双元载体T-DNA顺利转移)。
pEHA101(pTiBo542DT-DNA)型Ti质粒含有筛选标签:strep、kan,赋予EHA101菌株链霉素抗性和卡那霉素抗性,适用于玉米、水稻、烟草等植物的转基因操作,经pK7WGF2质粒检测转化效率可达104cfu/μgDNA。EHA101电转感受态特别适用于大质粒的转化:经pK7WGF2质粒(壮观霉素抗性,size:11876 bp)检测转化效率>105 cfu/μg DNA;经pK7WGF2-ZH质粒(size:40 kd)检测转化效率可达5×103 cfu/μg DNA。
制备方法:
1.0.1 cm电击杯和杯盖从储存液中拿出倒置于干净的吸水纸上5分钟,待其沥干水分,正置5分钟,使乙醇充分挥发,待乙醇挥发干净立即插入冰中,压实冰面,电极杯顶离冰面0.5 cm以方便盖上杯盖,冰中静置5分钟充分降温。
2.取-80℃保存的农杆菌感受态插入冰中5分钟,待其融化,加入1-5μg质粒DNA(质粒体积不大于6ul,用试剂盒抽提,双蒸水溶解),用手拨打管底混匀,立即插入冰中,用200μl枪头将感受态-质粒混合物快速移到电击杯中,盖上杯盖,空管保留待用。
3.启动电转仪,设置参数:C=25μF,PC=200 ohm,V=2400 V(此参数为Biorad推荐,使用者也可按所用电转仪推荐的protocol操作),将电击杯快速放入电转槽中,电击完成快速插入冰中,加入700μl无抗生素的LB并转移到感受态空管中,28℃振荡培养2~3小时。
4.6000 rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素的LB或YEB平板上,倒置放于28℃培养箱培养2-3天(当平板只含有转化所用双元载体抗生素时,28℃培养48小时即可;平板中同时加入双元载体抗生素,20μg/ml rif时,需28℃培养60小时;如果使用的平板含有50μg/ml rif则需要28℃培养72-90小时)。
注意事项
1.加入质粒时体积不应大于感受态体积的1/10;质粒不纯或存在乙醇等有机物污染,转化效率急剧下降;质粒增大一倍,转化效率下降一个数量级。
2.混入质粒时应轻柔操作。转化高浓度的质粒可相应减少最终用于涂板的菌量。
3.平板上阳性克隆密度过大时,由于营养不足,阳性克隆生长变慢,菌落变小,为了获得大的菌落,应减少质粒用量。
4.利福平浓度不应高于25μg/ml,过高的利福平浓度不利于农杆菌生长,会降低其生长速度和转化效率。
5.培养基中加入利福平的目的是防止杂菌生长、筛选农杆菌;根据所用菌株抗性加入Ti质粒筛选抗生素可防止Ti质粒丢失,但Ti质粒筛选抗生素不利于农杆菌的转基因操作,所以一般培养农杆菌时不考虑这些抗生素,Ti质粒丢失的概率极低(可以忽略)。
应用[7][8]
EHA101 Electro感受态细胞可用于植物基因克隆转化研究:
在玉米zma-miR169c及其靶基因ZmNF-YA13的克隆与表达分析实验中以玉米郑58为材料,研究玉米zma-miR169c及其靶基因ZmNF-YA13在植物响应非生物胁迫中的作用。qPCR结果表明,玉米幼苗在受到干旱、ABA、缺钾、NaCl、Na2CO3及低温胁迫时地上部分和地下部分的zma-miR169c及其靶基因ZmNF-YA13都呈不同程度的上调或下调表达。
由此,可推测zma-miR169c及其靶基因ZmNF-YA13可能与植物抗非生物胁迫相关。zma-miR169c及其靶基因ZmNF-YA13在玉米的根、茎、叶、雄穗、花丝和种子中都有表达,且在雄穗、花丝和种子中表达量较高。由此,可推测zma-miR169c及其靶基因ZmNF-YA13可能与玉米的生殖发育有关。通过PCR扩增的方法克隆得到319 bp的基因序列,其中包含134 bp的zma-miR169c前体序列,102 bp上游旁侧序列及83 bp下游旁侧序列。
Blastn比对结果表明zma-miR169c前体序列与miRBase中B73玉米的pre-miR169c的序列同源性为100%。构建了玉米表达载体ubi:zma-pre-miR169c,并采用冻融法将其转入农杆菌EHA101中。通过部分编码区的扩增、3’RACE和5’端PCR的方法克隆出长为1147 bp的ZmNF-YA13基因,其中ORF 822 bp,5’UTR 47 bp,3’UTR 278 bp,共编码273个氨基酸,其中3’UTR上含有zma-mi R169c的切割位点。氨基酸序列分析表明,其含有NF-YB/C结合区、DNA结合区及中间连接区这三个保守结构域。ZmNF-YA13氨基酸序列与其它植物来源的NF-YA3同源性为39%-72%。系统发育分析结果表明,ZmNF-YA13与小麦的TaNF-YA10的亲缘关系最近。
上述结果表明该基因为NF-YA家族成员。构建了玉米表达载体ubi:ZmNF-YA13(ORF)、ubi:ZmNF-YA13(ORF+3’UTR)和烟草表达载体35s:ZmNF-YA13(ORF),并采用冻融法将其转入农杆菌EHA101中。通过农杆菌介导的叶盘转化法将35s:ZmNF-YA13(ORF)转入烟草中,共获得6个转化株系。通过基因组PCR、RT-PCR及半定量RT-PCR检测转基因植株ZmNF-YA13基因的转入及表达情况,选择表达量较高的L3和L4株系用于后续干旱生理实验。
参考文献
[1]The NF-YA transcription factor OsNF-YA7 confers drought stress tolerance of rice in an abscisic acid independent manner[J].Dong-Keun Lee,Hyung Il Kim,Geupil Jang,Pil Joong Chung,Jin Seo Jeong,Youn Shic Kim,Seung Woon Bang,Harin Jung,Yang Do Choi,Ju-Kon Kim.Plant Science.2015
[2]The overexpression of an Amaranthus hypochondriacus NF-YC gene modifies growth and confers water deficit stress resistance in Arabidopsis[J].Paola A.Palmeros-Suárez,Julio A.Massange-Sánchez,Norma A.Martínez-Gallardo,Josaphat M.Montero-Vargas,Juan F.Gómez-Leyva,John P.Délano-Frier.Plant Science.2015
[3]Overexpression of a NF-YB3 transcription factor from Picea wilsonii confers tolerance to salinity and drought stress in transformed Arabidopsis thaliana[J].Tong Zhang,Dun Zhang,Yajing Liu,Chaobing Luo,Yanni Zhou,Lingyun Zhang.Plant Physiology and Biochemistry.2015
[4]Overexpression of a NF‐YC transcription factor from bermudagrass confers tolerance to drought and salinity in transgenic rice[J].Miao Chen,Yujuan Zhao,Chunliu Zhuo,Shaoyun Lu,Zhenfei Guo.Plant Biotechnol J.2015(4)
[5]Overexpression of wheat NF-YA10 gene regulates the salinity stress response in Arabidopsis thaliana[J].Xiaoyan Ma,Xinlei Zhu,Chunlong Li,Yinling Song,Wei Zhang,Guangmin Xia,Mei Wang.Plant Physiology and Biochemistry.2015
[6]Expression of zma-miR169 miRNAs and their target ZmNF-YA genes in response to abiotic stress in maize leaves[J].Mingda Luan,Miaoyun Xu,Yunming Lu,Lan Zhang,Yunliu Fan,Lei Wang.Gene.2014
[7]High‐throughput deep sequencing shows that micro RNA s play important roles in switchgrass responses to drought and salinity stress[J].Fuliang Xie,Charles Neal Stewart,Faten A.Taki,Qiuling He,Huawei Liu,Baohong Zhang.Plant Biotechnol J.2014(3)
[8]尹鑫.玉米zma-miR169c及其靶基因ZmNF-YA13的克隆与表达分析[D].大连理工大学,2017.
欢迎您浏览更多关于EHA101感受态细胞的相关新闻资讯信息
