OGT抗体的应用
发布日期:2024/11/15 14:09:35
背景[1-3]
OGT抗体是一种可以特异性结合OGT的人工合成抗体,可以靶向结合人、小鼠、大鼠和猪样品中的OGT蛋白。OGT抗体可用于多种科学应用,包括Western Blot、免疫组织化学、免疫细胞化学、免疫沉淀和ELISA。
OGT基因编码一种糖基转移酶,该酶催化在O-糖苷键中向丝氨酸或苏氨酸残基添加单个N-乙酰氨基葡萄糖。由于磷酸化和糖基化都竞争相似的丝氨酸或苏氨酸残基,因此这两个过程可能会竞争位点,或者它们可能会通过空间或静电效应改变附近位点的底物特异性。OGT蛋白质包含多个四肽重复序列,这些重复序列是识别底物所必需的。O-GlcNAc(O-linked N-acetylglucosamine)糖基化修饰是一种细胞内动态的蛋白质翻译后修饰。O-GlcNAc糖基转移酶(O-linked N-acetylglucosamine tra nsferase transferase,OGT)以UDP-GlcNAc作为供体底物,将单个N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)与蛋白质的丝氮酸或苏氨酸的羟基形成O-糖苷键,而这种修饰的去除是由糖苷酶(O-GlcNAcase,OGA)完成的。细胞内超过3000种蛋白具有O-GlcNAc修饰,O-GlcNAc修饰参与了细胞信号转导、配受体相互作用、病毒感染、转录调节、细胞分化、细胞应答以及蛋白质翻译与降解等生物过程。
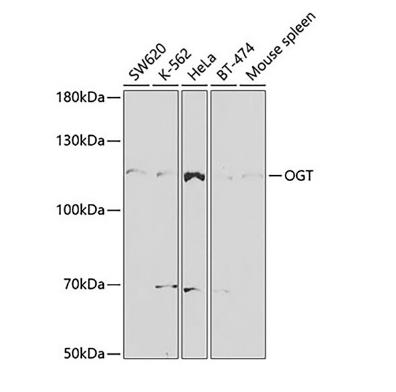
OGT抗体
OGT抗体使用步骤(Western Blot):
1.样本制备
1)融解RIPA裂解液(RIPA裂解液-细胞/组织裂解液缓冲液),混匀。
2)贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗一遍。加入150-250μL裂解液的比例加入裂解液。
3)充分裂解后,10000-14000g离心3-5min,取上清,即可进行后续的PAGE、Western和免疫沉淀等操作。
2.蛋白电泳
1)取出预制胶,将预制胶固定在电泳槽中,内槽加满tris-glycine电泳缓冲液。
2)在室温或不超过37℃的水浴中溶解5XSDS-PAGE上样缓冲液。水浴溶解后立即室温存放。
3)混合蛋白样品和5XSDS-PAGE蛋白上样缓冲液。
4)100℃或沸水浴加热3-5min,以充分变性蛋白,之后冷却至室温备用。
5)上样蛋白,并在1个孔中上样蛋白marker,盖上电泳槽盖,打开电源,电泳至蓝色染料到达胶的底端处附近即可停止电泳。
6)电泳后取出胶板,用刀在侧边硅胶处,沿着两片玻璃缝隙切开硅胶,即可打开玻璃板;取胶时。
3.转膜与封闭
1)将胶浸于预冷的转膜缓冲液中平衡5min。
2)依据胶的大小剪取膜和滤纸6片,放入预冷的转膜缓冲液中平衡10min,如用PVDF膜,需参照说明书,先用纯甲醇浸泡1-2min,再孵育于预冷的转膜缓冲液中。
3)装配转移三明治:海绵/3层滤纸/胶/膜/3层滤纸/海绵,每层放好后,用试管赶尽气泡。
4)将转移槽置于冰浴中,放入三明治,膜靠近阳极,胶靠近阴极,加入转移缓冲液,插上电极,100V,1h(电流约为0.3A)。
5)转膜结束后,切断电源,取出膜。
6)将膜浸没在5mL丽春红染色液中,置于轨道摇床上室温染色5~10min或更长,直待膜上显示出蛋白条带。
7)清洗:取出膜,用蒸馏水,PBS或者其他适当溶液冲洗至背景清晰后拍照,大概冲洗2~3次,每次5min。
8)脱色:将膜放到0.1N NaOH溶液漂洗5min;倒去洗脱液,再重复一次。
9)清洗:再用蒸馏水清洗膜2~3次,每次5min。
10)将膜置于25mL封闭缓冲液中,在室温下孵育1小时。
11)用5mL TBST洗涤三次,每次15min。
4.抗体孵育与检测
1)将膜和一抗(OGT抗体按照产品应用推荐稀释度)置于10mL一抗稀释缓冲液中在4℃下孵育过夜并不时轻轻晃动。
2)用5mL TBST洗涤三次,每次15min以去除残留的一抗(OGT抗体)。
3)将膜和二抗(按照产品应用推荐稀释度)置于10mL封闭缓冲液中孵育1-2小时并不时轻轻晃动。
4)用5mL TBST洗涤三次,每次15min。
5)最后一次洗膜的同时,按照ECL超敏试剂盒说明书,新鲜配制发光工作液。
6)用平头镊取出膜,搭在滤纸上沥干洗液。将膜完全浸入发光工作液中,与发光工作液充分接触。室温孵育3min,准备立即压片曝光。但勿洗去发光液。
7)显影曝光。
应用[4][5]
OGT抗体可以用于利用酿酒酵母构建OGT活性检测及新底物筛选体系
在酿酒酵母细胞中表达OGT的不同亚型,构建了OGT各亚型独立的研究体系;此外,鉴定了表达sOGT的酿酒酵母中O-GlcNAc修饰的内源蛋白,并对新发现的O-GlcNAc修饰蛋白进行了验证。
研究结果如下:(1)OGT三个蛋白亚型的主要差别是N端氨基酸序列的不同,我们的研究发现外源表达不同的OGT亚型对酿酒酵母生长抑制作用具有差异性,这些差异与OGT的N端氨基酸序列的不同组成密切相关;短OGT(short OGT,sOGT)对酿酒酵母的抑制作用依赖于其糖基转移酶的活性,而核质OGT(nuclear/cytoplasma OGT,ncOGT)和线粒体OGT(mitochondrial OGT,mOGT)的抑制作用不依赖于其催化活性;表达sOGT的酿酒酵母细胞可用于进行OGT的底物分析。(2)mOGT具有使其定位于线粒体内膜的N端基质导向序列(matrix targeting sequence,MTS)。在酿酒酵母中表达人源mOGT及其N端截短的突变体后,生长点板显示mOGT对酿酒酵母生长抑制作用依赖于其N端MTS序列;MTS序列的表达能引起酵母线粒体的融合,因此表达MTS序列的酿酒酵母有望成为哺乳动物细胞中mOGT过表达导致细胞凋亡的研究模型。(3)利用sWGA agarose对表达sOGT的酵母细胞中O-GlcNAc修饰的内源蛋白进行富集,并通过nanoLC-MS/MS鉴定到了468个O-GlcNAc修饰的酵母蛋白质,其中有13个被修饰的蛋白具有与其氨基酸序列一致性高于30%的人源蛋白,而且该人源蛋白的O-GlcNAc修饰状态在哺乳动物中尚未被报道。从中挑选了泛素结合酶2(ubiquitin-conjugating enzyme E2-16 kDa,Ubc5)、真核肽段释放因子的GTP结合亚基(eukaryotic peptide chain release factor of GTP-binding subunit,Sup35)、支链氨基酸转氨酶2(cytosolic branched-chain-amino-acid aminotransferase,Bat2)及组蛋白乙酰转移酶(histone acetyltransferase,Esa1)等蛋白与sOGT在酿酒酵母中共表达,通过OGT抗体蛋白质的免疫沉淀及抗O-GlcNAc的蛋白印迹实验发现Ubc5、Sup35、Bat2及Esa1均被O-GlcNAc修饰,从而验证了我们的O-GlcNAc修饰蛋白的富集及质谱分析方法是可信的。
参考文献
[1]RNA Aptamers Rescue Mitochondrial Dysfunction in a Yeast Model of Huntington’s Disease[J].Kinjal A.Patel;;Rajeev K.Chaudhary;;Ipsita Roy.Molecular Therapy-Nucleic Acids.2018
[2]A review of the role of chemical modification methods in contemporary mass spectrometry-based proteomics research[J].Alexander Leitner.Analytica Chimica Acta.2018
[3]A Conserved Splicing Silencer Dynamically Regulates O-GlcNAc Transferase Intron Retention and O-GlcNAc Homeostasis[J].Sung-Kyun Park;;Xiaorong Zhou;;Kathryn E.Pendleton;;Olga V.Hunter;;Jennifer J.Kohler;;Kathryn A.O’Donnell;;Nicholas K.Conrad.Cell Reports,2017(5)
[4]Yeast cells as an assay system for in vivo O-GlcNAc modification[J].Hideki Nakanishi;;Feng Li;;Baoxian Han;;Seisuke Arai;;Xiao-Dong Gao.BBA-General Subjects.2017
[5]李凤.利用酿酒酵母构建OGT活性检测及新底物筛选体系[D].江南大学,2020.
欢迎您浏览更多关于OGT抗体的相关新闻资讯信息
