Ac-DEVD-pNA(Caspase 3显色底物)
发布日期:2020/2/18 7:59:45
背景[1-7]
Ac-DEVD-pNA(Caspase 3显色底物)是一种Caspase 3的显色底物。Caspase 3是一种蛋白酶,当细胞暴露在细胞凋亡的条件下时具有快速催化活性,会切断多聚(ADP-ribose)聚合酶。Ac-DEVD-pNA是caspase-3的首选肽类底物被广泛应用于细胞生物学、化学生物学和药用化学领域中。目前,Ac-DEVD-pNA主要用于检测细胞中caspase-3和caspase-7的活性,也用于鉴定和评估caspase-3和caspase-7抑制剂和procaspase-3/7的小分子激活剂。
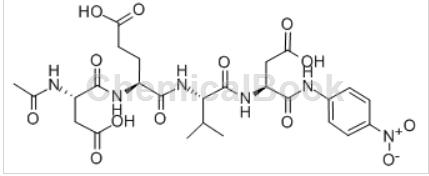
其具体作用机理是:Caspase-3或caspase-7催化Ac-DEVD-pNA的水解,继而释放出发色基团对硝基苯胺,通过对对硝基苯胺发色强度的检测,相应检测出体内caspase-3或caspase-7的活性大小。在综合考虑成本、原子经济性、绿色环保的基础上选用液相多肽合成法合成克级规模的caspase-3/7底物:Ac-DEVD-pNA。
主要的合成步骤:(1)Fmoc-Asp(Ot-Bu)-OH与对硝基苯胺反应:由于对硝基苯胺的氨基亲核性较低,故以三氯氧磷为强活化剂在低温条件下反应,柱色谱分离纯化后产率可达74.2%;(2)多肽缩合:以PyBOP为缩合试剂,在室温条件下即可反应迅速,每步缩合产率都在90%以上;(3)氨基脱保护:室温下,在二乙胺的二氯甲烷溶液中脱除氨基保护基Fmoc保护基,反应迅速,脱除彻底,产率可达到90%以上;(4)羧基脱保护:最后,用三氟乙酸对所有羧基脱保护得到目标产物。
以4-乙基-2-丁基-5-苄基四唑硫酸乙酯离子液体为催化剂高产率的合成了7-氨基-4-甲基香豆素。该离子液体的具体合成路线:(1)利用1,3-偶极环加成反应,以苯乙腈和叠氮钠为原料,水作溶剂,溴化锌为催化剂合成5-苄基四唑,产率可达78%;(2)以1-溴丁烷为丁基化试剂,DBU为碱催化剂,合成2-丁基-5-苄基四唑,产率可达61%;(3)将2-丁基-5-苄基四唑与硫酸二乙酯加入甲苯中回流得到目标离子液体,产率可达74%。
应用[8][9]
Ac-DEVD-pNA(Caspase 3显色底物)可用于癌症细胞凋亡机制的Caspase 3蛋白水平检测:
在以大黄素对人宫颈癌细胞HeLa增殖的抑制作用及作用机制实验中人宫颈癌细胞HeLa为研究系统。给予一定浓度的大黄素后,通过以下实验来检测其对人宫颈癌细胞HeLa增殖的抑制作用及作用机制。
1.MTT法(四甲基偶氮唑盐微量酶反应比色法)检测大黄素在不同浓度,不同时间点情况下对HeLa细胞增殖的抑制作用,并初步筛选出有效的抑制浓度。2.TUNEL染色法(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法)和Hoechst33342染色法初步检测大黄素诱导人宫颈癌细胞HeLa凋亡的作用。3.FCM法(流式细胞分选)中利用AnnexinV-FITC和PI定量检测大黄素诱导HeLa细胞凋亡的作用。4.Trizol法提取HeLa细胞的总RNA,逆转录合成CDNA,然后利用Real-time PCR法定量检测凋亡基因Caspase-9、-8、和-3的mRNA表达水平。5.提取HeLa细胞的蛋白质,利用Western blot法检测凋亡相关蛋白Cytochome c.Apaf-1、Fas、FasL、FADD、Pro-caspase-9、Pro-caspase-8和Pro-caspase-3的蛋白表达水平。
Western blot结果显示,随着浓度的增加(0、20、40和80μM),大黄素能够剂量依赖性的增加Cytochome c.Apaf-1、Fas、FasL和FADD的蛋白表达水平,但是降低Pro-caspase-9、Pro-caspase-8和Pro-caspase-3的蛋白表达水平。以上结果说明,大黄素通过内源性线粒体途径和外源性死亡受体途径诱导细胞凋亡从而抑制了人宫颈癌Hela细胞的增殖。
参考文献
[1]PAC-1 Activates Procaspase-3 in Vitro through Relief of Zinc-Mediated Inhibition[J].Quinn P.Peterson,David R.Goode,Diana C.West,Kara N.Ramsey,Joy J.Y.Lee,Paul J.Hergenrother.Journal of Molecular Biology.2009(1)
[2]Peptide substrate for caspase-3 with 2-aminoacridone as reporting group[J].Valentin Lozanov,Ivaylo P.Ivanov,Bistra Benkova,Vanio Mitev.Amino Acids.2009(3)
[3]Caspase-9 Holoenzyme Is a Specific and Optimal Procaspase-3 Processing Machine[J].Qian Yin,Hyun Ho Park,Jee Y.Chung,Su-Chang Lin,Yu-Chih Lo,Li S.da Graca,Xuejun Jiang,Hao Wu.Molecular Cell.2006(2)
[4]Peripheral proteasome and caspase activity in Parkinson disease and Alzheimer disease[J].F Blandini,E Sinforiani,C Pacchetti,A Samuele,E Bazzini,R Zangaglia,G Nappi,E Martignoni.Neurology.2006(4)
[5]A Substrate-Phage Approach for Investigating Caspase Specificity[J].Samantha Lien,Richard Pastor,Daniel Sutherlin,Henry B.Lowman.The Protein Journal.2004(6)
[6]Samarium(III)catalyzed one-pot construction of coumarins[J].Sushilkumar S.Bahekar,Devanand B.Shinde.Tetrahedron Letters.2004(43)
[7]Mechanism of XIAP-Mediated Inhibition of Caspase-9[J].Eric N Shiozaki,Jijie Chai,Daniel J Rigotti,Stefan J Riedl,Pingwei Li,Srinivasa M Srinivasula,Emad S Alnemri,Robert Fairman,Yigong Shi.Molecular Cell.2003(2)
[8]Inactivating mutations of caspase-8 gene in colorectal carcinomas[J].Hong Sug Kim,Jong Woo Lee,Young Hwa Soung,Won Sang Park,Su Young Kim,Jong Heun Lee,Jik Young Park,Youg Gu Cho,Chang Jae Kim,Seong Whan Jeong,Suk Woo Nam,Sang Ho Kim,Jung Young Lee,Nam Jin Yoo,Sug Hyung Lee.Gastroenterology.2003(3)
[9]王耀先.大黄素激活Caspase-3等因子诱导人宫颈癌HELA细胞凋亡机制的研究[D].黑龙江中医药大学,2013.
欢迎您浏览更多关于AC-DEVD-PNA (CASPASE 3显色底物)的相关新闻资讯信息
