急性骨髓性白血病药物:恩西地平
发布日期:2024/5/20 8:30:24
介绍
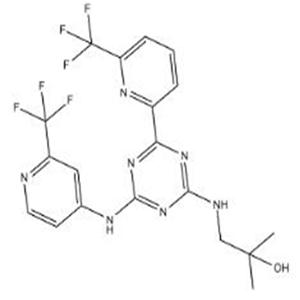
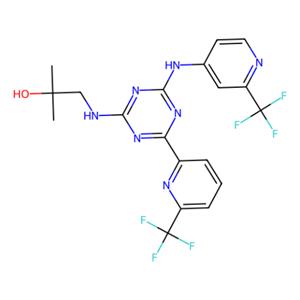
恩西地平 (Enasidenib) 以甲磺酸盐的形式成药, 化学名为:2-甲基-1-[ (4-[6- (三氟甲基) 吡啶-2]-6-{[2- (三氟甲基) 吡啶-4-]氨}-1, 3, 5-三嗪-2-氨]丙烷-2-醇甲磺酸盐,分子式为C19H17F6N7O·CH3SO3H (C20H21F6N7O4S)。它由美国食品药品管理局 (FDA) 于2017年8月1日批准新基公司开发上市, 用于治疗携带异柠檬酸脱氢酶2 (isocitrate dehydrogenase 2, IDH2) 基因突变的成人急性骨髓性白血病(AML)患者。它属于第一代IDH2抑制剂, 可以抑制多种促进细胞增殖的酶活性。如果患者血液或骨髓样本中检测到了IDH2突变, 便适用于接受恩西地平治疗。作为首个获批的专门治疗这一特定疾病的新药, 它在获批上市前曾获得美国FDA颁发的“优先审评”资格和“孤儿药”认定。

恩西地平
成分与用量
恩西地平的上市剂型为片剂, 规格100 mg/片 (相当于120 mg恩西地平甲磺酸盐) 或50 mg/片 (相当于60 mg恩西地平甲磺酸盐) , 每片含无活性成分二氧化硅胶体、羟丙基纤维素、醋酸琥珀羟丙甲纤维素、氧化铁黄、硬脂酸镁、微晶纤维素、聚乙二醇、聚乙烯醇、硫酸月桂酸钠、羧甲淀粉钠、滑石和二氧化钛。推荐起始剂量为100 mg, 每天口服1次, 至少维持6个月。
药理作用
不同于传统的化疗和免疫疗法, 肿瘤代谢疗法是通过降低致癌代谢物间接抑制肿瘤生长。IDH2是线粒体中三羧酸循环的关键酶, 催化异柠檬酸到酮戊二酸 (α-ketoglutaric acid, α-KG) 的转化。AML患者中的IDH2变异不仅丧失正常的催化功能, 而且能催化α-KG生成致癌的2-羟基戊二酸 (2-hydroxyglutarate, 2-HG) [6], 同时导致DNA和组蛋白过度甲基化[7]。恩西地平靶向IDH2变异体, 与它的活性中心结合, 抑制了2-HG的生成[8]。
体外实验证实, 与对照品野生型的IDH2比较恩西地平对IDH2的3种突变体R140Q、R172K和172S显示了更强大的抑制活力 (超过40倍) , 能有效降低2-HG水平[9]。它能逆转组蛋白和DNA的过度甲基化;在白血病细胞中诱导细胞分化, 伴随着外周血细胞中CD11b+的表达提高和c-Kit受体表达降低。动物实验表明, 它能够有效降低移植小鼠骨髓、血浆和尿液中2-HG水平;恢复由突变体IDH2抑制的巨核红细胞分化, 逆转突变体IDH2在突变干细胞中对DNA甲基化效应[10];能显著降低2-HG水平, 最大抑制程度为90.6%, 诱导骨髓细胞分化, 不会带来细胞毒性, 迄今也未观察到它能带来细胞遗传异常以及引发IDH2变异[11]。对1个单次剂量30 mg至650 mg和多次剂量100 mg每天在空腹状态测定心电图, 未观察到QTc间期明显变化[9]。目前正在进行中的临床研究发现IDH2抑制剂和其他靶向AML的疗法相结合, 能显著提高疗效[12]。
药动学
FDA公布的数据显示, 恩西地平单次剂量100mg的血浆峰浓度 (Cmax) 为1.3µg/m L, 该值出现的中位时间为4 h;每天服用100 mg, 在29 d里达到稳态血药浓度 (13µg/m L) ;每天给药50~450 mg的浓度时间曲线下面积 (AUC) 的增加与剂量成正比;口服100 mg的生物利用度约57%, 其均数分布容积为55.8 L。在体外, 人血浆蛋白结合率为98.5%, 它的代谢物AGI-16903与人血浆蛋白结合率为96.6%。它的末端半衰期是137 h, 平均消除速率为0.740 74 L/h[9]。它的代谢通过细胞色素P450酶 (CYP) 和葡萄糖醛酸转移酶 (UGTs) , 其代谢产物AGI-16903可由CYP1A2、CYP2C19和CYP3A4, 以及UGT1A1、UGT1A3和UGT1A9进一步降解。放射性标记后进入体循环, 89%的放射性来自恩西地平, 它的代谢物AGI-16903放射性占10%。体外研究提示它的代谢是通过CYP酶家族介导, 或通过多个UGTs酶家族来完成。代谢物AGI-16903的进一步代谢也是通过CYP1A2、CYP2C19、CYP3A4、UGT1A1、UGT1A3和UGT1A9等多个酶介导的。
该药主要通过粪便清除, 在粪和尿的清除分别占89%和11%[9]。没有观察到体质量、性别、年龄、轻度肾受损 (定义为肌酐清除率≥30 m L/min) 和轻微肝功能受损 (总胆红素≤正常上限和天冬氨酸转移酶>正常上限) 会对恩西地平药动学产生有临床意义的影响。体外研究发现它能和其代谢物AGI-16903被CYP家族及UGT家族中多个酶代谢。鉴于此, 同时服用能抑制上述酶的药物不会对稳态血药浓度的恩西地平产生临床意义的作用。
安全性评价
FDA公布的数据显示[9], 服用恩西地平最常见的不良反应包括恶心 (48%) 、疲倦 (41%) 、腹泻 (41%) 、胆红素升高 (33%) 和食欲下降 (34%) ;属严重的不良反应有分化综合征 (7%) 、白细胞减少 (4%) 、肿瘤溶解综合征 (3%) 和高胆红素血症 (2%) 。在动物生殖研究中, 在器官形成期至分娩前, 给予恩西地平导致大鼠流产率和早产死亡率增加, 它可能会对发育中的胎儿或新生婴儿造成伤害。因此, 怀孕或哺乳期女性不应服用。目前尚未确定该药在儿童患者中的安全性和有效性。建议有生殖潜能的患者, 治疗期间和末次剂量后至少1个月应采取有效避孕。在临床研究中无需对剂量调整, 未观察到患者年龄65岁或以上和较年轻患者间在有效性或安全性方面的总体差别。
参考文献
[1] Gross S, Cairns R A, Minden M D, et al.Cancerassociated metabolite 2-hydroxyglutarate accumulates in acute myelogenous leukemia with isocitrate dehydrogenase 1 and 2 mutations[J].J Exp Med, 2010, 207 (2) :339-344.
[2] Figueroa M E, Abdel-Wahab O, Lu C, et al.Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation[J].Cancer Cell, 2010, 18 (6) :553-567.
[3] Dang L, Yen K, Attar E C.IDH mutations in cancer and progress toward development of targeted therapeutics[J].Ann Oncol, 2016, 27 (4) :599-608.
[4] Idhifa (enasidenib) tablets[EB/OL]. (2017-08-01) [2017-10-09].https://www.accessdata.fda.gov/drug-satfda_docs/nda/2017/209606orig1s000toc.cfm
[5] Gras J.Enasidenib mesylate[J].Drug Future, 2017, 42 (1) :15-20.
[6] Kim E S.Enasidenib:first global approval[J].Drug, 2017, 77 (15) :1705-1711.
[7] Amatangelo M D, Quek L, Shih A, et al.Enasidenib induces acute myeloid leukemia cell differentiation to promote clinical response[J].Blood, 2017, 130 (6) :732-741.
[8] Stein E M, Dinardo C D, Pollyea D A, et al.Enasidenib in mutant-IDH2 relapsed or refractory acute myeloid leukemia[J].Blood, 2017, 130 (6) :722-731.
[9] 王环玉, 赵烨, 刘相奎.异柠檬酸脱氢酶抑制剂研究进展[J].中国新药杂志, 2017, 26 (11) :1272-1278.
[10] 白煜, 朱志超, 蒋丽佳, 等.苦参碱对人原代白血病细胞的体外作用研究[J].药物评价研究, 2015, 38 (3) :262-266.
[11]黄丹燕.治疗急性骨髓性白血病新药恩西地平[J].药物评价研究,2018,41(04):703-706.
欢迎您浏览更多关于恩西地平的相关新闻资讯信息