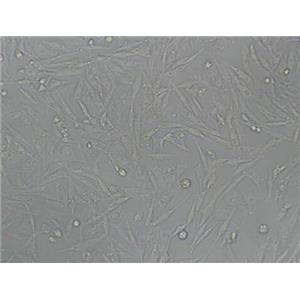
UMNSAH/DF-1 鸡胚胎成纤维细胞系的应用
发布日期:2023/9/6 17:21:53
背景[1-3]
UMNSAH/DF-1鸡胚胎成纤维细胞系是起源于10日龄的ELL-0鸡蛋的鸡细胞株,自发永生化。分离原代鸡胚成纤维细胞并在培养液中培养;传代直到衰老;在衰老过程中离心以保持细胞培养在30%到60%满;不衰老的克隆进行鉴定并传代不少于30次。在软琼脂上没有观察到克隆增殖,说明这些细胞是永生化而没有转化。该细胞可作为病毒增殖、重组蛋白表达和重组病毒生产的基质。
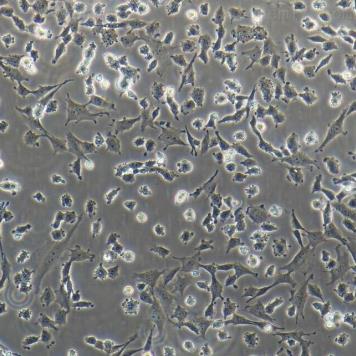
UMNSAH/DF-1鸡胚胎成纤维细胞系
UMNSAH/DF-1鸡胚胎成纤维细胞系细胞培养操作规程
一.培养基及培养冻存条件准备:
1)准备DMEM(NaHCO3 1.5g/L)培养基;优质胎牛血清,10%;双抗1%;细胞冻存后复苏存活率只有50%左右,建议加大冻存密度。
2)UMNSAH/DF-1鸡胚胎成纤维细胞系培养条件:气相:空气,95%;二氧化碳,5%。温度:39℃,培养箱湿度为70%-80%。
3)UMNSAH/DF-1鸡胚胎成纤维细胞系冻存液:90%血清,10%DMSO,现用现配。
二.UMNSAH/DF-1鸡胚胎成纤维细胞系细胞处理:
1,复苏UMNSAH/DF-1鸡胚胎成纤维细胞系细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,离心管加入4mL培养基混合均匀。在800-1000RPM条件下离心4-5分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有细胞悬液加入T25培养瓶中培养,补加培养基至6ml。
2,UMNSAH/DF-1鸡胚胎成纤维细胞系细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加1ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于39℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量完全培养基终止消化。
3.轻轻打匀后吸出,在1000RPM条件下离心5分钟,弃去上清液,加1-2mL培养液后吹匀。
4.将细胞悬液按1:2到1:5比例分到新的含6ml培养基的新皿中或者瓶中。
注:次传代推荐传代比例为1:2,以后传代比例可根据客户需要自己决定。
3)UMNSAH/DF-1鸡胚胎成纤维细胞系细胞冻存:待细胞生长状态良好时,可进行细胞冻存。
1,UMNSAH/DF-1鸡胚胎成纤维细胞系细胞冻存时,弃去培养基后,PBS清洗一遍后加入1ml胰酶,细胞变圆脱落后,加入1ml完全培养基终止消化,可使用血球计数板计数。
2,4min 1000rpm离心去掉上清。加1ml血清重悬细胞,根据细胞数量加入血清和DMSO,轻轻混匀,DMSO终浓度为10%,细胞密度1-2xE6/ml,每支冻存管冻存1ml细胞悬液,注意冻存管做好标识。
3,将冻存管置于程序降温盒中,放入-80度冰箱,至少2个小时以后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4-5]
UMNSAH/DF-1鸡胚胎成纤维细胞系可以用于鸡DF-1细胞中STAT1基因缺失对传染性法氏囊病毒和新城疫病毒增殖的影响
以细胞基质生产病毒疫苗具有安全高效的特点,如UMNSAH/DF-1鸡胚胎成纤维细胞系、非洲绿猴肾细胞(Vero)等常用细胞作为基质在疫苗生产中发挥巨大作用。然而,由于细胞免疫的原因,很多类型的病毒并不能在这些细胞中扩增,或者扩增效率很低。随着人们对免疫信号通路相关基因研究的深入,采取基因编辑技术将细胞或动物的内源性免疫基因进行敲除,可从根本上改变细胞免疫性状,进而优化疫苗生产工艺,提高疫苗生产效率。STAT1基因在信号转导和转录激活的关键性作用可影响免疫信号通路发挥作用。
对UMNSAH/DF-1鸡胚胎成纤维细胞系中STAT1基因进行敲除,探究STAT1-ko细胞对传染性法氏囊病毒(IBDV)和新城疫病毒(NDV)病毒增殖的影响。
研究结果如下:一、通过CRISPR/Cas9技术敲除UMNSAH/DF-1鸡胚胎成纤维细胞系中的STAT1基因为了得到STAT1基因稳定敲除的UMNSAH/DF-1鸡胚胎成纤维细胞系,针对STAT1第二外显子上设计了3个sg RNA打靶位点,将构建好的sg RNA敲除载体共同转染鸡DF-1细胞,通过挑单细胞克隆的方式收集转染阳性细胞并进行PCR鉴定和测序分析。结果显示,STAT1基因的打靶位点发生了碱基片段缺失,造成了编码阅读框的移码突变,说明我们得到了STAT1稳定敲除的UMNSAH/DF-1鸡胚胎成纤维细胞系。为了验证敲除STAT1基因后对鸡DF-1细胞生长速度和细胞形态的影响,首先,在显微镜下观察细胞形态;其次,采用细胞计数绘制两种细胞的生长曲线;随后,通过q-PCR检验两种细胞生长与黏附相关基因编辑表达量。结果显示,与野生型DF-1细胞相比,STAT1-ko细胞生长速度和细胞形态没有显著差异,细胞生长及黏附相关基因的表达量差异不显著,说明敲除STAT1基因并未对UMNSAH/DF-1鸡胚胎成纤维细胞系的生长速度和细胞形态产生影响。
二、敲除STAT1基因对DF-1细胞感染IBDV的影响本试验用IBDV感染STAT1基因缺失和野生型两种细胞,然后对其进行q-PCR和TCID50检验,探究敲除STAT1基因对鸡DF-1的影响。结果显示,与野生型DF-1细胞相比,STAT1-ko细胞中STAT1下游的OASL等免疫相关基因表达量显著降低,IBDV的基因表达量和滴度均显著提高,说明STAT1-ko细胞对IBDV的敏感性提升,IBDV在细胞内的增殖速度显著提升。
三、敲除STAT1基因对UMNSAH/DF-1鸡胚胎成纤维细胞系感染NDV的影响本研究用NDV感染STAT1基因缺失和野生型两种细胞,然后对其进行q-PCR和TCID50检验,探究敲除STAT1基因对鸡DF-1的影响。结果显示,与野生型DF-1细胞相比,STAT1-ko细胞中STAT1下游的OASL等免疫相关基因和干扰素等免疫基因的表达量均显著降低,NDV基因的表达量和病毒滴度均显著提高,说明STAT1-ko细胞对NDV的敏感性提升,NDV在细胞内的增值速度显著提升。
综上所述,本研究通过CRISPR/Cas技术对UMNSAH/DF-1鸡胚胎成纤维细胞系中的STAT1基因进行敲除,IBDV和NDV在STAT1缺失鸡DF-1细胞增殖速度提高。研究结果为鸡STAT1基因后续研究和鸡DF-1细胞的后续应用提供了重要参考。
参考文献
[1]Emerging Roles of lncRNAs Regulating RNA-Mediated Type-I Interferon Signaling Pathway.Ji Xiaoxin;Meng Wei;Liu Zichuan;Mu Xin.Frontiers in Immunology,2022
[2]Baicalin suppresses the progression of Type 2 diabetes-induced liver tumor through regulating METTL3/m6A/HKDC1 axis and downstream p-JAK2/STAT1/clevaged Capase3 pathway.Jiang Hongpeng;Yao Qianqian;An Yongbo;Fan Linlin;Wang Jing;Li Huiying.Phytomedicine,2022
[3]Schisandrin B promotes TH1 cell differentiation by targeting STAT1.Guo Jufeng;Shen Yingying;Lin Xia;Chen Honggang;Liu Jian.International Immunopharmacology,2021
[4]A recent perspective on fiber and hexon genes proteins analyses of fowl adenovirus toward virus infectivity-A review..Sohaimi Norfitriah Mohamed;HairBejo Mohd.Open veterinary journal,2021
[5]钟菁.鸡DF-1细胞中STAT1基因缺失对传染性法氏囊病毒和新城疫病毒增殖的影响[D].广西大学,2023.
欢迎您浏览更多关于UMNSAH/DF-1 鸡胚胎成纤维细胞系的相关新闻资讯信息