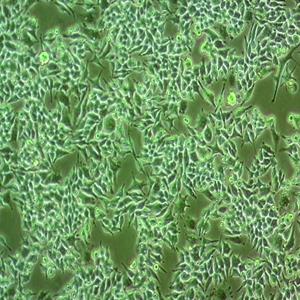
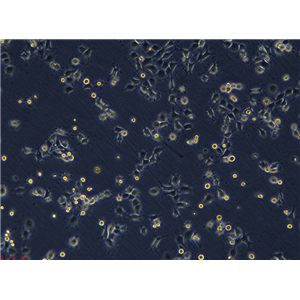
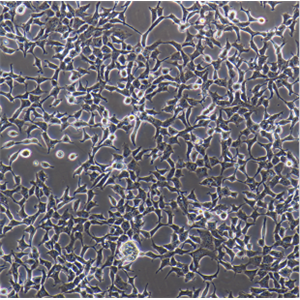
HTR-8/SVNEO 人绒毛膜滋养层细胞系的应用
发布日期:2023/8/28 10:33:00
背景[1-3]
HTR-8/SVNEO人绒毛膜滋养层细胞系是通过转染人妊娠前期胎盘绒毛膜外植体的细胞获得的,其基因编码人猿病毒40大T抗原。这些转染的滋养细胞可用于研究滋养细胞生物学和胎盘功能。它们可能提高我们对肿瘤进展、子痫前期胎盘异常低侵袭性和滋养细胞肿瘤高侵袭性相关疾病的认识。该细胞系已被证明同时包含上皮细胞和间充质样细胞群。
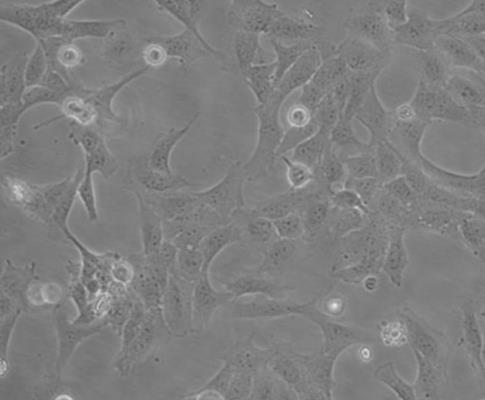
HTR-8/SVNEO人绒毛膜滋养层细胞系
HTR-8/SVNEO人绒毛膜滋养层细胞系细胞培养操作
1)复苏HTR-8/SVNEO人绒毛膜滋养层细胞系细胞:以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4mL培养基混合均匀。在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入10cm皿中,加入约8ml培养基,培养过夜)。第二天换液并检查细胞密度。
2)HTR-8/SVNEO人绒毛膜滋养层细胞系细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
c、按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8ml培养基的新皿中或者瓶中。
3)HTR-8/SVNEO人绒毛膜滋养层细胞系细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
HTR-8/SVNEO人绒毛膜滋养层细胞系可以用于TNF-α通过miR-145-5p下调Cyr61表达抑制人绒毛膜滋养层细胞系HTR8/SVneo细胞侵袭能力的研究
以HTR8/SVneo细胞为模型,研究TNF-α/miR-145-5p/Cyr61轴对HTR8/SVneo侵袭和迁移能力的影响,并着重探讨其中的分子机制,以期为子痫前期在临床上的抗TNF-α治疗提供依据,并试图为临床上子痫前期的早期诊断提供分子标志,为子痫前期的临床治疗提供靶标。
方法(1)分别利用转化生长因子-β(TGF-β)、溶血磷脂酸(LPA)、白介素35(IL-35)和肿瘤坏死因子(TNF-α)处理HTR8/SVneo细胞,利用划痕实验检测上述因子对HTR8/SVneo细胞迁移能力的影响,根据实验结果选择对HTR8/SVneo细胞迁移能力影响较大的细胞因子进一步研究分子机制。
(2) 根据筛选结果,选择TNF-α做进一步研究,筛选TNF-α影响HTR8/SVneo细胞迁移能力的下游分子,使用不同浓度TNF-α处理HTR8/SVneo细胞,分别利用real time RT-PCR和Western blotting在mRNA和蛋白水平检测侵袭相关转录因子MSH同源盒蛋白2(MSX2)、叉头框蛋白M1(FOXM1)、转录因子插头框蛋白O1(FOXO1)、信号转导和转录激活因子3(STAT3)和富含半胱氨酸蛋白61(Cyr61)等分子的表达情况。
(3) 依据筛选结果,确定Cyr61为TNF-α影响HTR8/SVneo细胞迁移能力的主要下游分子,利用基因克隆技术分别构建Cyr61慢病毒表达载体和Cyr61靶向shRNA表达载体,转染HEK293细胞包装成慢病毒颗粒,感染HTR8/SVneo细胞,利用划痕实验、Transwell等检测Cyr61对细胞迁移和侵袭能力的影响。
(4) 进一步证实探讨TNF-α影响Cyr61表达的分子机制,利用生物信息学和real time RT-PCR技术筛选TNF-α处理HTR8/SVneo细胞后,miRNAs的表达谱变化,筛选到miR-145-5p在TNF-α处理HTR8/SVneo细胞后升高;利用生物信息学和双荧光素报告系统验证miR-145-5p对Cyr61 mRNA沉默作用;利用合成miR-145-5p mimics、anti-miR-145-5p分别转染HTR8/SVneo细胞,Western blotting实验用来检测转染后HTR8-SVneo细胞中Cyr61的表达情况。利用划痕实验、Transwell等检测转染细胞迁移和侵袭能力变化。在HTR8/SVneo细胞中转染miR-145-5p inhibitor 48h后,用10 ng/mL TNF-α处理:划痕实验和Transwell实验用来检测TNF-α处理的HTR8/SVneo细胞中降低miR-145-5p表达对TNF-α介导的侵袭抑制的影响;
结果(1)分别利用不同浓度TGF-β、LPA、IL-35和TNF-α处理HTR8/SVneo细胞24h后,划痕实验结果表明,TGF-β、LPA和IL-35对细胞的迁移能力没有明显影响,但是,终浓度为10 ng/ml和100 ng/ml的TNF-α可以显著抑制细胞的侵袭能力(P<0.05)。
(2) real time RT-PCR结果表明,TNF-α处理的HTR8/SVneo细胞中侵袭相关转录因子Msx2、FOXO1、FOXM1、STAT3和Cyr61 mRNA表达均没有明显变化;Western blotting结果显示,TNF-α处理的HTR8/SVneo中侵袭相关转录因子Msx2、FOXO1、FOXM1和STAT3的表达没有显著变化,但是Cyr61蛋白表达水平显著降低(P<0.05)。
(3) 成功构建了Cyr61表达载体(pCDH-CMV-MCS-EF1-GFP-Puro-Cyr61)和Cyr61靶向shRNA表达载体(pLKO.1-Cyr61-shRNA-1和pLKO.1-Cyr61-shRNA-2),并包装成重组慢病毒颗粒,感染HTR8/Svneo细胞;real time RT-PCR和Western blotting的检测结果表明,在感染pCDH-CMV-MCS-EF1-GFP-Puro-Cyr61重组慢病毒的HTR8/SVneo细胞中Cyr61在mRNA和蛋白水平表达均显著升高(P<0.05)。而在两株敲低细胞系中,Cyr61在mRNA和蛋白水平表达均显著降低(P<0.05),而且pLKO.1-Cyr61-shRNA-1比pLKO.1-Cyr61-shRNA-2的效果要强。
用pLKO.1-Cyr61-shRNA-2稳转的细胞做后续实验。划痕实验结果显示,过表达Cyr61能够促进HTR8/SVneo细胞的迁移率(P<0.05),而敲低Cyr61的表达则能够显著抑制HTR8/SVneo细胞的迁移率(P<0.05)。Transwell侵袭实验,我们得到了相似的结果。划痕实验和Transwell侵袭实验还显示,与转染载体的对照组细胞相比,过表达Cyr61的HTR8/SVneo细胞对TNF-α诱导的迁移和侵袭抑制具有明显的翻转效应。
参考文献
[1]Lysophosphatidic acid induces the crosstalk between the endovascular human trophoblast and endothelial cells in vitro.Jimena S.Beltrame;;Leopoldina Scotti;;Micaela S.Sordelli;;Vanesa A.Ca?umil;;Ana M.Franchi;;Fernanda Parborell;;María L.Ribeiro.Journal of Cellular Physiology,2019
[2]miR-145 overexpression triggers alteration of the whole transcriptome and inhibits breast cancer development.Peng Ye;;Yu Shi;;Nairui An;;Qian Zhou;;Juan Guo;;Xinghua Long.Biomedicine&Pharmacotherapy,2018
[3]MiR‐634 sensitizes glioma cells to temozolomide by targeting CYR 61 through Raf‐ERK signaling pathway.Zhigang Tan;;Jizong Zhao;;Yugang Jiang.Cancer Medicine,2018
[4]MicroRNA-145 alleviates high glucose-induced proliferation and migration of vascular smooth muscle cells through targeting ROCK1.Mantian Chen;;Yi Zhang;;Wei Li;;Jieying Yang.Biomedicine&Pharmacotherapy,2018
[5]文政芳.TNF-α通过miR-145-5p下调Cyr61表达抑制人绒毛膜滋养层细胞系HTR8/SVneo细胞侵袭能力的研究[D].广西医科大学,2019.
欢迎您浏览更多关于HTR-8/SVNEO 人绒毛膜滋养层细胞系的相关新闻资讯信息