大鼠软骨细胞的应用
发布日期:2023/7/24 9:21:54
背景[1-3]
大鼠软骨细胞分离自软骨组织;软骨组织由软骨细胞、基质及纤维构成。软骨组织再生能力强,这些增生的幼稚细胞形似纤维母细胞,以后逐渐变为软骨母细胞,并形成软骨基质,细胞被埋在软骨陷窝内而变为静止的软骨细胞。根据软骨组织内所含纤维成分的不同,可将软骨分为透明软骨、弹性软骨和纤维软骨三种,其中以透明软骨的分布较广,结构也较典型。
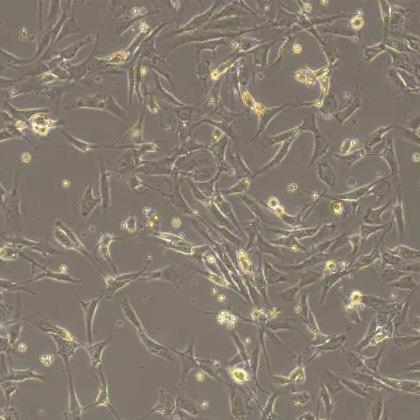
大鼠软骨细胞
软骨细胞(chondrocyte)位于软骨陷窝内。幼稚的软骨细胞位于软骨组织的表层,单个分布,体积较小,呈椭圆形,长轴与软骨表面平行,越向深层的软骨细胞体积之间增大呈圆形,细胞核圆形或卵圆形,染色浅,细胞质弱嗜碱性,常见数量不一的脂滴。成熟的软骨细胞多2-8个成群分布于软骨陷窝内,这些软骨细胞由同一个母细胞分裂增殖而成,称为同源细胞群。
电镜下,软骨细胞有突起和皱褶,细胞质内有大量的粗面内质网和发达的高尔基复合体及少量的线粒体。在组织切片中,软骨细胞收缩为不规则形,在软骨囊和细胞之间出现较大的腔隙。体外培养的软骨细胞对于研究其生理功能、药物作用以及各种致病因素作用下的病理生理改变具重要意义。
大鼠软骨细胞使用方法:
大鼠软骨细胞是一种贴壁细胞,细胞形态呈梭形、多角形,标准操作流程下,细胞可传5代左右;3代以内状态;建议您收到细胞后尽快进行相关实验。
客户收到细胞后,请按照以下方法进行操作。
1.取出T25细胞培养瓶,用75%酒精消毒瓶身,拆下封口膜,放入37℃、5%CO2、饱和湿度的细胞培养箱中静置3-4h,以稳定细胞状态。
2.大鼠软骨贴壁细胞消化
1)吸出T25细胞培养瓶中的培养基,用PBS清洗细胞一次;
2)添加0.25%胰蛋白酶消化液1mL至T25培养瓶中,轻微转动培养瓶至消化液覆盖整个培养瓶底后,吸出多余胰蛋白酶消化液,37℃温浴1-3min;倒置显微镜下观察,待细胞回缩变圆后,再加入5ml完全培养基终止消化;
3)用吸管轻轻吹打混匀,按传代比例接种T25培养瓶传代,然后补充新鲜的完全培养基至5mL,置于37℃、5%CO2、饱和湿度的细胞培养箱中静置培养;
4)待细胞完全贴壁后,培养观察;之后按照换液频率更换新鲜的完全培养基。
3.大鼠软骨细胞实验因原代细胞贴壁特殊性,贴壁的原代细胞在消化后转移至其他实验器皿(如玻璃爬片、培养板、共聚焦培养皿等)时,需要对实验器皿进行包被,以增强细胞贴壁性,避免细胞因没贴好影响实验;包被条件常选用鼠尾胶原Ⅰ(2-5μg/cm2),多聚赖氨酸PLL(0.1mg/ml),明胶(0.1%),依据细胞种类而定。悬浮/半悬浮细胞无需包被。
应用[4][5]
大鼠软骨细胞可以用于姜黄素通过p38MAPK/c-Myc信号轴对骨关节炎大鼠软骨细胞凋亡的影响
探索姜黄素对大鼠骨关节炎的疗效及姜黄素通过p38MAPK/c-Myc信号轴对骨关节炎大鼠软骨细胞凋亡相关机制的研究。
方法:36只雄性Sprague Dawley大鼠根据随机数字表随机分为4组:关节腔不作处理及不给予药物为空白对照组(control组),膝关节腔注入生理盐水不给予任何药物为NaCl组,膝关节腔注入碘乙酸钠溶液不给于任何药物为模型组(model组),膝关节腔注入碘乙酸钠溶液及给予姜黄素为姜黄素治疗组(MIA+Cur组),其中NaCl组与model组于造模3天后连续给予羧甲基纤维素钠(Carboxymethylcellulosesodium,CMC-Na)溶液2周,MIA+Cur组于造模3天后连续给予姜黄素2周,观察大鼠后肢挛缩状态及跛行情况,使用CatwalkXT步态分析系统分别于建模前3天(pre 3d)、建模后3天(post 3d)、建模后1周(post 1w)、建模后2周(post 2w)观察大鼠站立时间(Stand(s)),接触面积百分比(Max Contact At(%)),接触强度(Max Contact Max Intensity),并进一步采用DABTunel方法检测大鼠骨关节炎软骨细胞凋亡水平,以及用免疫组化方法检测大鼠骨关节炎软骨中p38MAPK、c-Myc和Caspase-3表达分布情况。
结果:与模型组比较,姜黄素治疗组大鼠在Stand(s)、Max Contact At(%)、Max Contact Max Intensity上明显改善(P<0.05),根据模型组大鼠关节软骨大体形态学、细胞形态学改变得出改良Mankins评分10分,DABTunel方法显示姜黄素治疗组中凋亡表达水平较模型组明显降低(P<0.05),免疫组织化学染色显示姜黄素治疗组中p38MAPK、c-Myc和Caspase-3表达情况较模型组明显降低(P<0.05)。
结论:碘乙酸钠能够改变大鼠大体形态学、软骨细胞形态学及步态,姜黄素能改善OA大鼠模型步态及骨关节炎大鼠软骨细胞凋亡情况,其机制可能是通过抑制OA软骨组织中p38MAPK、c-Myc和Caspase-3的表达影响软骨细胞的凋亡。
参考文献
[1]p38MAPK Signaling Pathway in Osteoarthritis:Pathological and Therapeutic Aspects..Li Zongchao;Dai Aonan;Yang Ming;Chen Siyu;Deng Zhenhan;Li Liangjun.Journal of inflammation research,2022
[2]Mesenchymal Stem Cell-Derived Exosomes Modulate Chondrocyte Glutamine Metabolism to Alleviate Osteoarthritis Progression.Jiang Kai;Jiang Ting;Chen Yang;Mao Xinzhan.Mediators of Inflammation,2021
[3]In Vivo Investigation of the Ameliorating Effect of Tempol against MIA-Induced Knee Osteoarthritis in Rats:Involvement of TGF-β1/SMAD3/NOX4 Cue.Abozalam Hagar B.;Abdelsalam Rania M.;AbdelRahman Rehab F.;AbdEllah Mohamed F.;Khattab Mahmoud M..Molecules,2021
[4]MCC950,the NLRP3 Inhibitor,Protects against Cartilage Degradation in a Mouse Model of Osteoarthritis.Ni Bowei;Pei Wenbin;Qu Yunkun;Zhang Rui;Chu Xiangyu;Wang Yingguang;Huang Xiaojian;You Hongbo.Oxidative Medicine and Cellular Longevity,2021
[5]刘琴琴.姜黄素通过p38MAPK/c-Myc信号轴对骨关节炎大鼠软骨细胞凋亡的影响[D].赣南医学院,2022.
欢迎您浏览更多关于大鼠软骨细胞的相关新闻资讯信息



