大鼠肝上皮样干细胞的应用
发布日期:2023/5/15 9:01:02
背景[1-3]
大鼠肝上皮样干细胞是成年Fischer 344大鼠正常肝上皮细胞系,呈单层生长,种群倍增在开始时为20-23小时,但在12.5小时后增加。
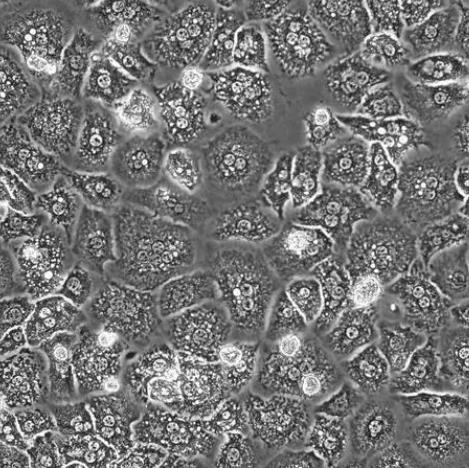
大鼠肝上皮样干细胞
大鼠肝上皮样干细胞培养条件:
1、大鼠肝上皮样干细胞培养基:RPMI-1640培养基(不含Hepes)+10%胎牛血清+1%双抗+800ng/ml Taxol
2、温度:37.0°C
3、气体:空气95%,CO2 5%
大鼠肝上皮样干细胞培养步骤:
一、复苏大鼠肝上皮样干细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入5mL培养基混合均匀。在1000RPM条件下离心5分钟,弃去上清液,补加4-6mL完全培养基后吹匀。然后将所有细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入6cm皿中),培养过夜。第二天换液并检查细胞密度。
二、大鼠肝上皮样干细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a)、对于大鼠肝上皮样干细胞,传代可参考以下方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗大鼠肝上皮样干细胞1-2次。
2.加1-2ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加5ml以上含10%血清的完全培养基终止消化。
3.轻轻吹打大鼠肝上皮样干细胞,完全脱落后吸出,在1000RPM条件下离心8-10分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.按5-6ml/瓶补加培养液,将JeKo-1细胞悬液按1:2的比例分到新的含5-6 ml培养液的新皿中或者瓶中。
三、大鼠肝上皮样干细胞冻存:
1、大鼠肝上皮样干细胞生长至覆盖培养瓶的80%面积时,弃25cm2培养瓶中的培养液,用PBS清洗细胞一次;
2、添加0.25%胰蛋白酶消化液约1ml至培养瓶中,倒置显微镜下观察,待大鼠肝上皮样干细胞回缩变圆后加入完全培养液终止消化,轻轻吹打细胞使之脱落,然后将悬液转移至15ml离心管中,1000rpm离心5min;
3、用适量的冻存液重悬大鼠肝上皮样干细胞,并放置于冻存管中;
4、先将大鼠肝上皮样干细胞冻存管放置于-20℃1.5h,然后将其移入-80℃。
应用[4][5]
大鼠肝上皮样干细胞可以用于体外诱导BMP7基因修饰的大鼠骨髓间充质干细胞向肾小管上皮样细胞分化的实验研究
观察体外肾小管上皮细胞(Normal Rat Kidney Epithelial Cells)缺氧复氧损伤(Hypoxia-reoxygenation,H/R)微环境下慢病毒介导的重组人骨形态发生蛋白7(human Bone Morphogenetic Protein-7,hBMP-7)转染对大鼠骨髓间充质干细胞(Rat Bone Mesenchymal Stem Cells,rBMSCs)向肾小管样上皮细胞分化的影响,初步探讨以BMSCs作为hBMP-7基因运载细胞,hBMP-7和rMSCs联合修复缺氧再灌注急性肾脏损伤的可行性。
方法:1、贴壁法分离培养SD大鼠乳鼠BMSCs,经CD29、CD34、CD44、CD45鉴定BMSCs,并绘制不同代数细胞生长曲线和贴壁率曲线分析其生物学特性。选取生物活性良好的第三代(P3)、四代(P4)BMSCs作为转染BMP7载体细胞;
2、构建编码绿色荧光蛋白(GFP)的重组人骨形态发生蛋白7慢病毒载体(Lv-hBMP-7-GFP),体外转染BMSCs后,MTT、Brdu标记及流式细胞分析Lv-hBMP-7-GFP转染对BMSCs生物活性的影响;
3、构建大鼠肾小管上皮细胞(NRK-52E)的缺氧复氧(H/R)模型,经流式细胞分析检测H/R后细胞凋亡情况,并在Transwell培养体系中与rMSCs共培养,分别于共培养后第3d、5d、7d收集细胞,经RT-PCR检测诱导后细胞E-钙粘蛋白(E-cadherin)的表达,并经免疫组化染色及流式细胞仪测定第18型细胞角蛋白(Cytokeratin18,CK-18)的阳性表达率。
结果:1、贴壁法可以简便提取原代BMSCs并进行体外扩增培养予以纯化;
2、构建的Lv-hBMP-7-GFP可以高效转染rMSCs,转染效率约为70%,转染后的rMSCs增殖活性无明显改变(0.322±0.022,0.302±0.017,0.319±0.031,0.311±0.029)(P<0.05)并可以持续稳定的分泌hBMP-7(5d后为0.329±0.043);
3、H/R NRK-52E与各组rMSCs随共培养时间的延长E-cadherin和CK-18表达增加(37.22±0.21,36.54±0.32,38.37±0.38,47.02±0.31),与单纯rMSCs培养组(2.43±0.18)、NRK-52E与rMSCs共培养组(8.52±0.27)、NRK-52E与转染Lv-BMP-7的rMSCs共培养组(8.65±0.22)比较存在显著性差异(P<0.01);H/R NRK-52E与转染Lv-BMP-7的rMSCs共培养组(47.02±0.31)与其他实验组(H/R NRK-52E与rMSCs共培养组、H/R NRK-52E与转染空病毒的rMSCs共培养组、H/R NRK-52E与BMP-7因子作用下的rMSCs共培养组)相比存在统计学差异(P<0.05)。
结论:体外大鼠肾小管上皮细胞缺氧复氧微环境下rMSCs可以有效向肾小管上皮样细胞分化,并且hBMP-7转染可以促进rMSCs的定向分化。研究结果可能为hBMP-7和BMSCs联合改善急性缺血再灌注所致的肾脏损伤提供新的研究方法。
参考文献
[1]Mesenchymal Stem Cells in Acute Kidney Injury[J].Benjamin D.Humphreys;Joseph V.Bonventre.Annual Review of Medicine,2008
[2]In vitro differentiation of human mesenchymal stem cells to epithelial lineage[J]..Journal of Cellular and Molecular Medicine,2007(3)
[3]Mesenchymal stem cells inhibit lymphocyte proliferation by mitogens and alloantigens by different mechanisms[J].Ida Rasmusson;;Olle Ringdén;;Berit Sundberg;;Katarina Le Blanc.Experimental Cell Research,2005(1)
[4]Transdifferentiation of mesenchymal stem cells into cardiomyocytes by direct cell-to-cell contact with neonatal cardiomyocyte but not adult cardiomyocytes[J].Jihyun Yoon;;Wan Joo Shim;;Young Moo Ro;;Do-Sun Lim.Annals of Hematology,2005(11)
[5]段修芳.体外诱导BMP7基因修饰的大鼠骨髓间充质干细胞向肾小管上皮样细胞分化的实验研究[D].南昌大学,2009.
欢迎您浏览更多关于大鼠肝上皮样干细胞的相关新闻资讯信息