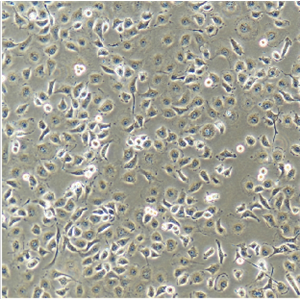
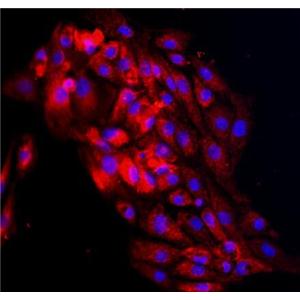
大鼠肾小管上皮细胞的应用
发布日期:2023/5/5 13:44:15
背景[1-3]
大鼠肾小管上皮细胞提取于大鼠肾脏组织,一代冻存。每管含有细胞数>5×10^5cells/ml,此细胞通过对Cytokeratin-18,-19和Vimentin的免疫荧光染色验证,经测试不含有支原体、细菌、酵母和真菌。细胞可以达到15倍增。
肾小管上皮细胞对肾功能起重要作用。它们几乎能重吸收肾小球滤过液中所有的葡萄糖和氨基酸,并使其它非营养物质排泄到尿液中。然而,它们也是先天缺陷,代谢和炎症疾病损伤的主要位点。肾小管上皮细胞能产生包括细胞因子和趋化因子在内的炎性介质,并通过产生IL-8从而影响和指导白细胞的分化来积极参与急性炎症过程。在肾脏移植后或新月体肾炎的炎症过程中,肾小管上皮细胞表达IL-2α受体和II类MHC抗原,这表明它们参与肾脏免疫系统损伤的发病机理。
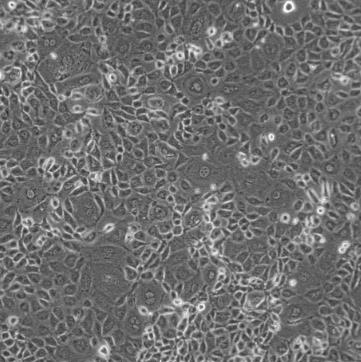
大鼠肾小管上皮细胞
大鼠肾小管上皮细胞培养操作
1)复苏大鼠肾小管上皮细胞:将含有1mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加入4mL培养基混合均匀。在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养基后吹匀。然后将所有大鼠肾小管上皮细胞悬液加入培养瓶中培养过夜(或将细胞悬液加入10cm皿中,加入约8ml培养基,培养过夜)。第二天换液并检查细胞密度。
2)大鼠肾小管上皮细胞传代:如果大鼠肾小管上皮细胞密度达80%-90%,即可进行传代培养。
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加1ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3.按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.将大鼠肾小管上皮细胞悬液按1:2比例分到新的含8ml培养基的新皿中或者瓶中。
3)大鼠肾小管上皮细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为类;
1.细胞冻存时,弃去培养基后,PBS清洗一遍后加入1ml胰酶,大鼠肾小管上皮细胞变圆脱落后,加入1ml含血清的培养基终止消化,可使用血球计数板计数。
2.4 min 1000rpm离心去掉上清。加1ml血清重悬大鼠肾小管上皮细胞,根据细胞数量加入血清和DMSO,轻轻混匀,DMSO终浓度为10%,细胞密度不低于1x106/ml,每支冻存管冻存1ml细胞悬液,注意冻存管做好标识。
3.将冻存管置于程序降温盒中,放入-80度冰箱,2个小时以后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
大鼠肾小管上皮细胞可以用于NF-κB蛋白在镉致大鼠肾小管上皮细胞损伤中的作用
以大鼠肾小管上皮细胞株(NRK-52E cells)为研究对象,通过NF-κB特异性抑制剂BAY 11-7082、NF-κB p65 siRNA(sip65)基因敲低和NF-κB激活剂佛波酯(Phorbol-12-myristate-13-acetate,PMA)来调节大鼠肾小管上皮细胞NF-κB的活性,探讨镉暴露后NF-κB蛋白在镉致大鼠肾小管上皮细胞损伤中的作用,为揭示镉的肾毒性机制提供理论依据。
1. 镉暴露激活NF-κB为研究镉对大鼠肾脏NF-κB蛋白表达的影响,以大鼠肾小管上皮细胞株(NRK-52E cells)为试验材料,不同浓度Cd(0、2.5、5、10μM)处理NRK-52E细胞12 h。Western blot法检测总蛋白IκB、NF-κB p65磷酸化水平、细胞核蛋白及胞浆蛋白NF-κB p65表达水平;GFP-p65质粒转染法检测细胞中NF-κB p65核转位。结果显示:与对照组相比,5、10μM Cd处理NRK-52E细胞总蛋白IκB、NF-κB p65磷酸化水平极显著升高、细胞核蛋白NF-κB p65表达极显著升高,胞浆蛋白NF-κB p65表达极显著降低(P<0.01)。结果表明Cd促进NF-κB核转位,且呈浓度依赖性。
2. NF-κB的激活拮抗镉致大鼠肾小管细胞损伤为探究镉激活的NF-κB在镉致大鼠NRK-52E细胞毒性损伤中的作用,使用NF-κB特异性抑制剂BAY 11-7082、基因敲低以及NF-κB激活剂PMA分别建立NF-κB的细胞抑制模型和激活模型。
具体处理如下:
(1) NF-κB抑制剂BAY 11-7082:0.5μM BAY 11-7082预处理2 h后与5μM CdCl2共处理12 h。
(2) NF-κB p65基因敲低:40 nM sip65转染24 h后,5μM CdCl2染毒12 h。
(3) NF-κB激活剂PMA:50 ng/mL PMA与5μM CdCl2共处理12h。处理结束后,相差显微镜下观察细胞形态,CCK-8法检测细胞存活率,RTCA法检测细胞增殖指数;Western blot法检测细胞总蛋白IκB、NF-κB p65磷酸化水平以及细胞核、胞浆蛋白NF-κB p65表达水平。
结果显示:(1)与对照组相比,Cd组IκB、NF-κB p65磷酸化水平极显著升高(P<0.01),NF-κB p65核转位极显著增加(P<0.01);与Cd组相比,Cd+BAY 11-7082组显著抑制IκB、p65磷酸化水平(P<0.05),极显著抑制镉诱导的NF-κB p65核转位(P<0.01);Cd+sip65组同样极显著抑制NF-κB核转位(P<0.01);与Cd组相比,Cd+PMA组极显著增加细胞核蛋白NF-κB p65表达水平(P<0.01)。以上结果说明该处理条件下NF-κB的正负调控有效,可以进行后续实验。
(2) 与对照组相比,Cd组细胞皱缩变圆、形态改变,细胞密度降低,存活率极显著下降(P<0.01);与Cd组相比,Cd+BAY 11-7082组和Cd+sip65组细胞形态损伤更为明显,存活率显著降低(P<0.05),Cd+sip65组细胞增殖指数明显下降;而Cd+PMA组细胞形态损伤得到缓解,细胞存活率显著提高(P<0.05)。以上结果提示我们,NF-κB的激活可能在NRK-52E细胞抵御镉的毒性损伤中发挥保护作用。
3.NF-κB参与镉暴露后大鼠肾小管细胞凋亡和自噬过程的调控为探究NF-κB在镉诱导的细胞凋亡与自噬抑制中的作用,建立NF-κB抑制模型和激活模型,利用Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率,GFP-RFP-LC3质粒转染检测细胞自噬流,Western blot检测细胞凋亡标志蛋白Bax、Bcl-2、cleaved caspase-3以及自噬标志蛋白LC3-II、p62表达水平。
参考文献
[1]The link between vitamin D status and NF-κB-associated renal dysfunction in experimental diabetes mellitus[J].Mazanova Anna;Shymanskyi Ihor;Lisakovska Olha;Labudzynskyi Dmytro;Khomenko Anna;Veliky Mykola.BBA-General Subjects,2022(7)
[2]Low-level exposure to lead,cadmium and mercury,and histopathological findings in kidney biopsies.[J].Barregard Lars;Sallsten Gerd;Lundh Thomas;M?lne Johan.Environmental research,2022
[3]Amelioration of Endotoxin-Induced Acute Lung Injury and Alveolar Epithelial Cells Apoptosis by Simvastatin Is Associated with Up-Regulation of Survivin/NF-kB/p65 Pathway[J].Ne?i?Lana;Amid?i?Ljiljana;?krbi?Ranko;Gajanin Radoslav;Mandi?Danijela;Dumanovi?Jelena;Milovanovi?Zoran;Ja?evi?Vesna.International Journal of Molecular Sciences,2022(5)
[4]Metallothionein and Cadmium Toxicology—Historical Review and Commentary[J].Nordberg Monica;Nordberg Gunnar F..Biomolecules,2022(3)
[5]刘文静.NF-κB蛋白在镉致大鼠肾小管上皮细胞损伤中的作用[D].扬州大学,2022.
欢迎您浏览更多关于大鼠肾小管上皮细胞的相关新闻资讯信息