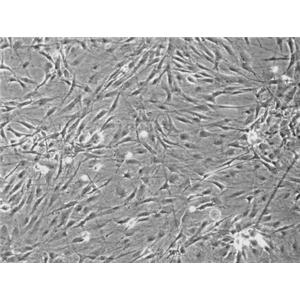
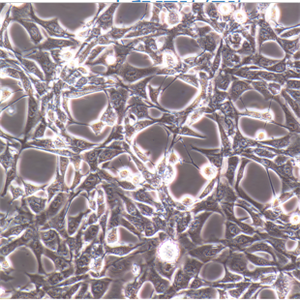
人脑血管周细胞的应用
发布日期:2022/6/28 10:44:17
背景[1-3]
人脑血管周细胞提取于人脑组织,原代冻存,此细胞通过对alpha-SMA抗体荧光免疫方法验证,经测试不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
周细胞是具伸缩性的类似平滑肌细胞的一类细胞,它们覆盖在微脉管的基底面。周细胞是小静脉的主要成分,并普遍存在于毛细血管中。在不同的组织和器官中,周细胞的数量和功能呈现很大的差异。周细胞的三种主要功能是(1)参与中枢神经系统微血管收缩性,(2)内皮细胞活性及(3)巨噬细胞活性的调节。也有证据表明周细胞与血脑屏障的物质转运及血管渗透性的调节有关。病理学研究显示,周细胞与高血压、糖尿病视网膜病变、阿尔海默氏病、多发性硬化和中枢神经系统肿瘤的形成有关。
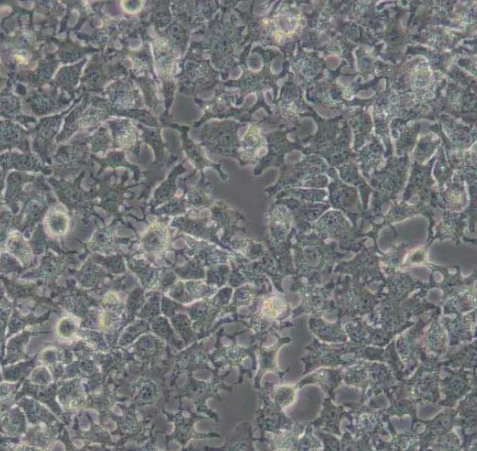
人脑血管周细胞
周细胞嵌入毛细血管内皮细胞的基膜中,通过物理接触和旁分泌信号与内皮细胞进行细胞通讯,监视和稳定内皮细胞的成熟过程。在大脑中周细胞帮助维持血脑屏障,周细胞是大脑神经血管单位的重要组成部分。此外,周细胞还具有调控毛细血管血流量、细胞碎屑清除和吞噬以及血脑屏障渗透性的作用。
在中枢神经系统中,周细胞包围着内皮细胞,这两种细胞很容易区分,周细胞中有明显的圆核而内皮细胞是扁平细长的细胞核。周细胞产生手指状的外延以调控毛细血管的血流量。周细胞和内皮细胞之间共同拥有一个基膜,基膜上有多种细胞连接,包括多种整合素、神经钙黏素、纤连蛋白以及接合素。
应用[4][5]
用于GPR124信号介导的脑血管周细胞极化及迁移机制研究
探索周细胞GPR124进行病毒表达沉默后,细胞的极化和迁移动态规律是否发生改变。在体的脑微血管损伤条件下,周细胞GPR124是否有相应的功能?由此,本课题采用心脑血管药理学技术手段(体内外疾病模型、双光子成像技术、现代分子生物学技术等)来深入阐明脑血管损伤危险因素下GPR124关联信号的精确调控机制。
内容具体如下:1.GPR124表达质粒的构建和鉴定目的:从小鼠血管内皮细胞中将GPR124克隆构建到哺乳动物表达载体上,在细胞实验和动物实验中研究其功能。方法和结果:HBVP细胞培养,TRIzol法提取细胞总RNA,RNA逆转录成cDNA,GPR124蛋白结构域预测及GPR124分子克隆和截断体构建。测序正确的全长GPR124基因构建入慢病毒pLenti-CMV-3FLAG载体,将该载体包装成慢病毒既可用于瞬时转染细胞,也可以用于在动物水平过表达GPR124基因。结论:本实验克隆得到了小鼠全长GPR124基因,构建到了哺乳动物表达载体pEGFP-N1,并构建了截断体。
2. GPR124在脑血管周细胞的表达定位研究目的:研究GPR124在周细胞的表达和定位,为开展GPR124在脑血管危险因素下参与周细胞极化、迁移等研究提供实验依据。方法与结果:HBVP细胞培养结合免疫组化荧光双染、共聚焦及随机光学重建显微(stochastic optical reconstruction microscopy,STORM)观察GPR124与F-actin共定位。我们发现鬼笔环肽(细胞骨架F-actin标记物)和GPR124共染色时,发现这些清晰可见的斑点是位于细胞骨架末端粘着斑结构,进一步也被GPR124与粘着斑标记蛋白vinculin的共定位所确认。结论:GPR124能与细胞骨架F-actin和粘着斑标记蛋白(vinculin)共定位,并且在伪足前部的表达量明显高于细胞其他部位,推测其可以参加细胞迁移的再粘附过程。
3. GPR124信号介导的脑血管周细胞极化及迁移机制研究目的:GPR124在脑血管危险因素下参与周细胞极化、迁移机制研究,为防治脑血管病药物靶标发现提供实验依据。方法与结果:采用饥饿与硝化应激作为刺激源来模拟脑血管损伤危险因素,我们发现无糖无血清饥饿12 h和硝化应激刺激源SIN-1处理的HBVP细胞与正常培养的细胞相比细胞的椭度和面积发生了变化。此外,划痕边缘细胞受某种损伤因子刺激导致GPR124在细胞运动前端表达增多。此外,我们的机制研究发现GPR124过表慢病毒侵染HBVP细胞后72 h,细胞免疫染色结果显示GPR124和极化蛋白PAR3在细胞伪足部位高表达。
细胞极化过程中,PAR3分布在细胞连接的顶端部分,推测其与GPR124共同调控周细胞极性的建立及维持。进一步,shRNA GPR124转染后72h,与对照组空质粒相比,微流控模型观察到了周细胞迁移能力的下降。碳素微栓脑微血管损伤模型显示,脑缺血1周后脑微血管周细胞与ki67阳性细胞共染,三维重建所用的系列光切图像(Z-stack)结果显示GPR124与NG2阳染细胞有很好的共定位特征。
结论:GPR124协同PAR3复合物共同参与介导脑血管损伤危险因素周细胞的极化、迁移。此外,周细胞GPR124参与损伤局部脑微血管的血管新生,推测具有潜在的脑功能修复作用。
参考文献
[1]GPR124 Functions as a WNT7-Specific Coactivator of Canonicalβ-Catenin Signaling[J].Ekaterina Posokhova,Animesh Shukla,Steven Seaman,Suresh Volate,Mary Beth Hilton,Bofan Wu,Holly Morris,Deborah A.Swing,Ming Zhou,Enrique Zudaire,Jeffrey S.Rubin,Brad St.Croix.Cell Reports.2015(2)
[2]Expression and prognostic value of CD97 and its ligand CD55 in pancreaticcancer[J].Zheng He,Hui Wu,Yanli Jiao,Jun Zheng.Oncology Letters.2015(2)
[3]RGD-conjugated solid lipid nanoparticles inhibit adhesion and invasion ofαvβ3 integrin-overexpressing breast cancer cells[J].Dan Shan,Jason Li,Ping Cai,Preethy Prasad,Franky Liu,Andrew Michael Rauth,Xiao Yu Wu.Drug Delivery and Translational Research.2015(1)
[4]The adhesion GPCR GPR126 has distinct,domain-dependent functions in chwann cell development mediated by interaction with Laminin-211[J].Sarah C.Petersen,Rong Luo,Ines Liebscher,Stefanie Giera,Sung-jin Jeong,Amit Mogha,Monica Ghidinelli,M.Laura Feltri,Torsten Schneberg,Xianhua Piao,Kelly R.Monk.Neuron.2014
[5]洪玲娟.GPR124信号介导的脑血管周细胞极化及迁移机制研究[D].浙江大学,2015.
欢迎您浏览更多关于HBVP的相关新闻资讯信息