人宫颈癌组织源细胞的应用
发布日期:2021/11/11 9:59:06
背景[1-3]
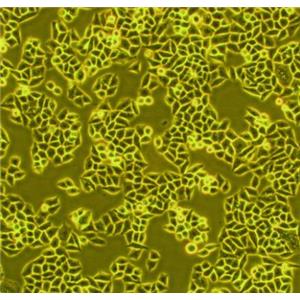
人宫颈癌组织源细胞分离自人宫颈癌组织纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。
宫颈癌是女性常见恶性肿瘤之一,由人类乳头瘤病毒(HumanPapillomavirus,简称HPV)引起的,按病理组织学主要分为腺癌、腺角化癌和鳞状细胞癌。宫颈癌细胞呈上皮样,贴壁生长,具有无限增殖能力,丧失接触抑制现象,癌细胞间粘着性减弱。此外,易于被凝集素凝集,细胞骨架结构发生紊乱。
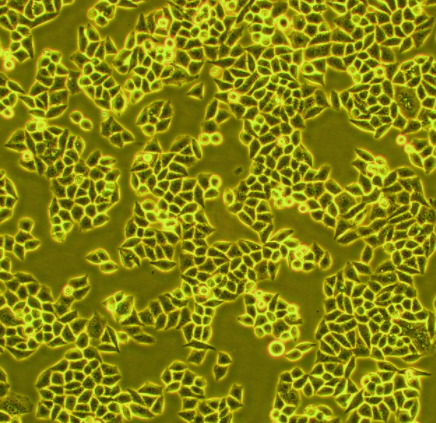
人宫颈癌组织源细胞
细胞分离方法:
1.将宫颈癌组织至于无菌的培养皿中用含双抗的1×PBS(pH=7.4)清洗若干次至无明显血细胞;
2.剪取宫颈癌组织边缘微血管丰富的组织,用含双抗的1×PBS(pH=7.4)清洗两次;
3.将剪取的宫颈癌边缘*成2-3mm3大小,加入含双抗的1×PBS(pH=7.4)清洗;
4.用进行过灭菌处理的玻璃滴管将剪碎的组织块和清洗用的1×PBS(pH=7.4)一起转入15ml离心管中;
5.250rpm/min离心2 min,小心倾去液体,再加入适量的含双抗的1×PBS(pH=7.4),用玻璃滴管吹吸液体以清洗组织块;
6.继续250rpm/min离心2 min,小心倾去液体,重复上述步骤若干次,直至离心后的液体中观察不到明显的红色;
7.将清洗好的组织块重新转至无菌的培养皿中,用无菌的200 ml的吸头将组织块贴于25cm2培养瓶中;
8.加入2ml培养基,将培养瓶倒置放于37℃、5%CO2的培养箱中2-3h之后正置培养瓶继续培养;
9.培养若干天后,可观察到组织块周围陆续有细胞爬出,继续培养几天,直至组织块周围的细胞达到较高密度(培养其间两天换液一次,换液操作时动作一定要轻柔,以防组织块被摇下);
10.当组织块附近的细胞生长到较高密度后,将贴壁的组织块吹下,换新的培养基继续培养24;
11.24h后,用0.25%的Trypsin-EDTA消化细胞,FBS中止消化,将消化后的细胞悬液转入15ml离心管,1000rpm/min离心5min,之后倾去废液,用培养基重悬细胞,转入原来的培养瓶中,继续在37℃、5%CO2的培养箱中培养。
应用[4][5]
用于冬凌草甲素诱导肿瘤细胞死亡的机制研究
对冬凌草甲素体外抗肿瘤活性进行了较为系统的研究,主要阐述了冬凌草甲素在三种肿瘤细胞:人黑色素瘤A375-82细胞,人宫颈癌HeLa细胞,小鼠纤维瘤L929细胞中诱导细胞死亡的不同机制。
在测定了三种来源血液的肿瘤细胞(人红白血病细胞系,K562;人组织淋巴瘤细胞,U937;人早幼粒白血病细胞,HL-60)和人黑色素瘤细胞,A375-S2;人宫颈癌细胞,HeLa;人乳腺癌细胞,MCF-7;小鼠纤维肉瘤细胞,L929细胞毒时发现三种血液系统的瘤株均对冬凌草甲素敏感,半数抑制浓度分别为:IC50(K562):16.2±1.2μmol/L,IC50(U937):27.1±2.3/μmol/L,IC50(HL-60):20.4±3.6μmol/L,另外三种人源细胞中以A375-S2细胞最敏感,IC50:15.1±1.2μmol/L,对其中鼠源细胞L929较敏感,IC50:35.6±4.2/μmol/L。
冬凌草甲素在对敏感细胞株有效浓度下作用于人外周血单核细胞(PBMC)12 h,没有细胞毒作用,但随着浓度的增加,对PBMCs具有较弱的细胞毒作用。
在A375-S2细胞实验中,Hoechst 33258荧光染色后证明34.3μmol/L冬凌草甲素作用细胞12 h时出现明显的凋亡小体,DNA电泳则表明大剂量的冬凌草甲素(137.4μmol/L)作用细胞12 h时出现坏死特有的弥散泳带。
采用流式细胞术及LDH活力测定进一步证明冬凌草甲素诱导A375-S2细胞死亡是平衡于凋亡与坏死之间。合适剂量的冬凌草甲素诱导细胞凋亡。
欢迎您浏览更多关于人宫颈癌组织源细胞的相关新闻资讯信息