单宁酸的应用,您知道多少?
发布日期:2021/7/14 13:59:37
单宁酸是一类多酚类化合物,广泛存在于植物体内,具有抗菌、抗寄生虫、抗病毒、抗氧化、抗炎,以及免疫调节等多种生物活性。因此,单宁酸是饲料中抗生素天然替代品的主要研究方向。植物单宁酸具有较强的蛋白质亲和力,已成功应用于反刍动物营养中,减少瘤胃蛋白质的降解,从而提高蛋白质的利用率和动物的生产效率。在反刍动物日粮中加入含单宁酸的饲料还具有三个重要作用,即控制动物胃气胀、肠道寄生虫和致病菌。单宁酸在传统上被认为是单胃动物和家禽的“抗营养因子”,但最近的研究表明单宁酸应用得当,改善了肠道微生物生态系统,增强了肠道健康,从而提高了生产性能。植物单宁酸作为饲料中抗生素替代品的适用性取决于许多因素,这些因素导致其观察到的效果的巨大的可变性。

单宁酸的化学结构
单宁酸是一种天然存在的多相酚类化合物,有不同的结构,具有结合和沉淀蛋白质的能力。单宁酸主要分为三大类:水解单宁酸(HT),缩合单宁酸(CT)也称为原花青素和褐藻多酚(PT)。前两组在陆生植物中发现,而PT只出现在海洋褐藻中(图1)。可水解的单宁酸由多酚核(通常为D-葡萄糖)组成,多酚核与酚酸(主要为没食子酸或六羟基二苯酸)酯化。HT的分子量在500~3000 Da之间(Haslam, 1989)。它们容易被酸、碱或酯酶水解,因此容易在消化道中降解和吸收,并可能对食草动物造成潜在的毒性作用(Dollahite et al.,1962;Mdeod, 1974)。缩合单宁酸是由黄烷-3-0单位组成的寡聚或聚合类黄酮,包括儿茶素、表儿茶素、没食子儿茶素和表没食子儿茶素。
与HT相比,CT的结构更为复杂,分子量更高1000~20000Da。与HT不同,只有强氧化和酸性水解才能解聚不容易被厌氧酶降解的CT结构(McSweeney et al., 2001)。PT是间苯三酚(1.3.5-三羟基苯)聚合的产物,在结构上没有陆地单宁(HT和CT)复杂(Ragan and Glombitza, 1986)。PT的分子量为126 - 650 kDa (Targett and Amold, 1998),根据其化学结构可分为6类(Phlorethols, Isofuhalos, Ehole, Fucole,Fuhalols, Fucophlorethols)。它们主要是通过丙二酸酯途径合成的(Herbert, 1989),虽然有其他合成途径被提出(Chen et al., 1997)。
单宁酸在植物界分布广泛,尤其在营养价值重要的牧草、灌木、谷类和药材中含量丰富(Salunkheet al.,1982: Wang et al.,1999)。在香蕉、黑莓、苹果和葡萄等许多水果中,以及茶中也发现有单宁酸(Nonaka et al., 1984: Bravo et al., 1992: Mertz et al.,2007; Mercurio and Smith, 2008; Kheng, 2010)。在饲料豆类,树木和灌木中最常见的类型是浓缩单宁酸,在热带地区HT通常存在于树叶和灌木叶中(Min et al, 2003)。通常情况下,在植物最脆弱的地方单宁酸更丰富,例如,新的叶子和花(Terrill et al., 1992; VanSoest,1982; Frutos et al., 2004)。PT集中在植体外皮层的细胞胞质中 (Ragan and Glombitza, 1986;鲁德和克莱顿,2004:柴田等,2004)。单宁酸的化学结构和浓度在植物种类、生长阶段和生长条件(如温度、光照强度、养分和暴露于食草环境)之间有很大的差异 (Frutos et al., 2004: Amslerand Fairhead, 2006; Berard et al., 2011; Li et al., 2014; Huanget al.2017)。
单宁酸的生物活性
单宁酸是植物次生代谢物,是植物抵御病原体入侵和昆虫侵袭的化学防御体系的重要组成部分。单宁酸具有许多生物活性,其中一些对现代食用动物生产最为重要,现综述如下。
抗菌性能
单宁酸的抗菌活性早已得到公认,单宁酸对细菌、真菌和酵母的毒性也有综述(Scalbert. 1991)。到目前为止单宁酸抗菌活性机制包括抑制胞外微生物酶,剥夺微生物生长所需的基质,通过氧化磷酸化抑制微生物代谢,剥夺金属离子或与引起细胞壁形态变化和膜透性增加的细菌形成细胞膜复合物(Scalbert, 1991; Liu et al., 2013)。证据表明微生物细胞膜是单宁酸抑制作用的主要场所(Mcallister et al., 2005;Liu et al.,2013),通过细胞聚合和细胞膜的破坏和功能(图2)。虽然蛋白质沉淀是所有单宁酸的普遍特性,但是单宁酸的抗菌活性是微生物种特异性的,与单宁酸的化学组成和结构密切相关。
一般来说,单宁酸对革兰氏阳性菌的抗菌活性大于对革兰氏阴性菌的抗菌活性(Ikigai et al., 1993; Smith andMackie, 2004),因为革兰氏阴性细菌的外膜是由脂质双层结构组成,脂质双层结构由外膜的脂多糖和蛋白质组成,内层由磷脂组成。然而,从几种植物中分离到的单宁酸,尤其是CT单宁酸对革兰氏阴性菌具有较强的抗菌活性。值得注意的是,大肠杆菌0157:H7、沙门氏菌、志贺氏杆菌、葡萄球菌、假单胞菌、幽门螺杆菌等病原菌均对单宁酸敏感(Funatogawa et al.,2004: Doss et al.,2009;Banso and Adeyemo, 2010;Liu etal.,2013)。
Wang等(2013)比较12种单宁酸,发现仅从紫色草原三叶草中分离的CT(Dalea purpurea Vent)和褐藻(Ascophylhum nodosum)中分离的PT具有较强的抗大肠杆菌和抗大肠杆菌0157:H7活性。褐藻多酚的抗菌活性也高于CT和HT (Wang et al.,2009)。已有研究表明,单宁酸氧化过程中羟基的数量和过氧化氢的释放是影响单宁酸抗菌性能的两个重要因素(Akagawa et al.,2003: Smith et al.2003:Mueller-Harvey, 2006)。有研究表明,具有三羟基B环的黄酮醇(没食子儿茶素)对链球菌、梭菌、变形杆菌和葡萄球菌的抑制作用大于具有二羟基B环的儿茶素(Sakanaka等,1985)。同样,表儿茶素没食子酸和表没食子儿茶素酸对肉毒杆菌的毒性也大于它们的非没食子对应物表儿茶素和表没食子儿茶素(Okuda et al.,1985)。由于单宁酸的来源广泛其抗菌活性具有很大的多样性,因此筛选和鉴定对目标微生物有效且特异的单宁酸将是一项连续不断的研究工作。
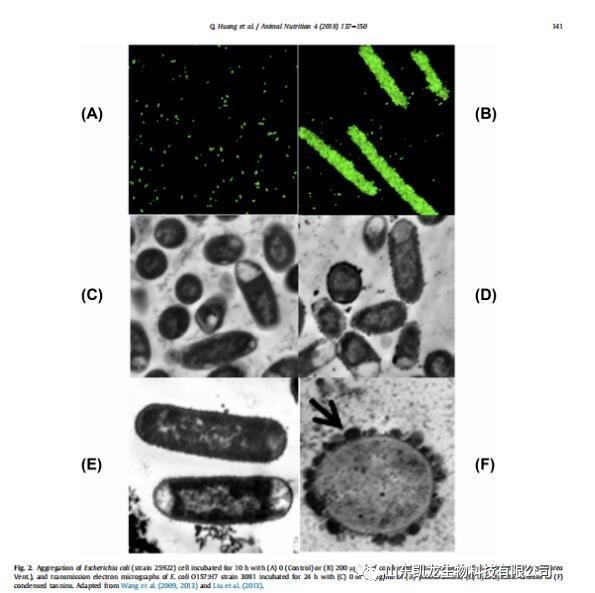
图2 透射电子显微图,引自Wang et al.(2009, 2013)和Liu et al. (2013)
(A)大肠杆菌(25922株)细胞培养10 h(对照组)、(B) 200 ug /ml紫色牧场三叶草的浓缩单宁酸
(C)大肠杆菌(3081株)孵化24 h(对照组)、(D) 50 ug / mL 酚类单宁酸
(E)50 ug / mL可水解单宁酸、(F) 50 ug / mL浓缩单宁酸
抗寄生虫性能
单宁酸的抗寄生虫特性已在体内和体外的研究中得到证实。从豆类牧草中提取的浓缩单宁酸,如红豆素、大三叶草、牛角花和蝶儿草等,以剂量依赖的方式降低了红毛圆线虫卵的孵化比例,抑制肺线虫和胃肠道线虫的发育呈剂量依赖性的方式(Molan et al ., 2000 a, 2000 b, 2002)。四种热带植物单宁酸提取物主要影响捻转血矛线虫和蛇形毛圆线虫其幼虫蜕皮过程(Alonso-Diaz et al., 2008a, 2008b)。从白坚木(Athanasiadou et al.,2001)、菊苣(Molan et al.,2003)和绿茶(Molan et al.,2004)中提取的单宁酸对幼虫的迁移有明显的抑制作用,且呈剂量依赖性。这些结果表明单宁酸的抗寄生虫作用发生在寄生虫生命周期的不同阶段。在体外研究中观察到的各种单宁酸的抗寄生虫作用,在许多绵羊和牛的体内研究中得到证实(Paolini et al., 2003; Heckendorn etal., 2007; Chaweewan et al.,2015; Desrues et al., 2016)。
植物单宁酸的驱虫机制已经被提出,“直接”作用寄生虫细胞,通过1)减少感染性的第三阶段幼虫在宿主体内,从而减少宿主入侵,2)减少线虫成虫虫卵排泄,3)降低第三阶段幼虫发育(Athanasiadou et al., 2001,2005;Brunet et al., 2008; Hoste et al., 2012)和通过“间接”作用提高宿主对线虫的抵抗力(Coop and Kyriazakis, 2001; Min etal., 2003; Tzamaloukas et al., 2006; Pathak et al., 2016)。然而,与它们的抗菌活性相似,单宁酸的驱虫效果也因单宁酸的化学成分和结构、寄生虫种类或生长阶段和/或宿主种类的不同而异(Hoste et al., 2006,2012)。
抗氧化性能
天然酚类化合物长期以来被认为是有效的抗氧化剂(Rice-Evans et al., 1995, 1996),单宁酸的抗氧化性能在食品工业和医学领域有着广泛的应用,可预防心血管疾病、癌症或骨质疏松症等氧化应激相关疾病(Hollman and Katan, 1999; Scalbert etal., 2005)。结果表明,相对分子质量较高的CT和HT具有较强的抗氧化活性(Hagerman et al.1998)。羟基的数量和单宁酸的聚合程度被认为与清除自由基的能力有关(Ariga and Hamano,1990),单宁酸中羟基最多最容易被氧化(Hodnick et al.,1988),因此单宁酸具有的抗氧化活性。Ricci等(2016)证明,单宁酸作为天然抗氧化剂的有效性是由于其还原和氧化还原活性的复杂组合,这也有助于其清除自由基。
单宁酸作为潜在的生物抗氧化剂已在许多体外研究中得到证实(Ho et al., 1999; Lin et al., 2001Beninger and Hosfield, 2003: Barreira et al., 2008)。单宁酸在不同动物组织中的体内抗氧化活性也得到了证实。添加含有CT的饲料可以提高牛羊的血清抗氧化活性,从而改善牛羊的抗氧化状态 (Dutta et al., 2012: Dey and De,2014; Huang et al.. 2015: Peng et al.. 2016)。在羊的日粮中添加白坚木单宁酸改善了肌肉 (Luciano et al., 2011),肝脏和血浆 (López-Andrés et al., 2013)的抗氧化状态,并通过在冷藏过程中延迟肌红蛋白氧化来增强肉色的稳定性(Luciano et al., 2009)。由于HT在吸收前在胃肠道中被降解,而CT不能在消化道中被降解和吸收,因此很难解释单宁酸作为完整的实体如何在动物体内发挥抗氧化活性。Lopez-Andres et al.(2013)发现白坚木单宁酸并未在胃肠道中降解或吸收,但是在绵羊肝脏和血浆的抗氧化能力增加,这说明CT可能间接影响动物组织的抗氧化状态。单宁酸蛋白络合已经表明单宁酸的抗氧化活性降低但没有消除(Riedl and Hagerman, 2001: Arts etal., 2002)。据推测,膳食单宁酸可能会在消化过程中使其他营养性抗氧化剂得以保留,也可能在消化过程中保护消化道中的蛋白质、碳水化合物和脂质免受的氧化损伤(Marshall and, Roberts, 1990)。然而,单宁酸在动物组织中的抗氧化机制尚不清楚。这一领域还需要进一步的研究,因为提高抗氧化能力被认为是饲喂单宁酸对动物健康和性能的收益之一。
抗炎性能
单宁酸具有不同的抗炎活性 (Mota et al., 1985; Terra et al.,2007; Sugiura et al., 2013; Park et al.,2014),与抗氧化活性呈正相关 (Gonçalves et al., 2005; Souza etal., 2007; Park et al., 2014)。体外研究表明,葡萄籽中的单宁酸通过调节细胞因子的表达可以降低低级别炎症性疾病,如肥胖 (Terra et al., 2007; Chacon et al.,2009)。从黑树莓籽中提取的CT具有抑制脂多糖诱导RAW264.7细胞产生一氧化氮(NO)(一种诱导炎症的促炎介质)的能力,显示了其抗炎活性(Park et al.,2014)。宽苞水柏枝单宁酸水解物对巴豆油致小鼠耳部水肿及胶原诱导的DBA/1小鼠关节炎均有明显的抗炎作用(Liu et al., 2015a,b)。作者推测抗炎作用机制与清除自由基的能力有关,而不是HT对NO和促炎细胞因子产生的抑制作用。来源于A. nodosum和Ecklonia cava的褐藻多酚在抑制细胞因子释放 (Dutot et al., 2012)、NO和前列腺素- E2产生的能力上也显示出强大的抗炎作用(Wijesinghe et al., 2013)。需要指出的是,这一领域的研究大多是利用体外模型进行的。单宁酸在动物体内消化后的抗炎作用尚需在体内模型中进一步评价。
抗病毒性能
单宁酸已被证明对某些病毒有显著的活性,例如…人体免疫缺陷病毒(HIV),牛腺相关病毒和诺如病毒(Uchiumi et al., 2003: Dil Pasqualeet al. 2012: Zhang et al., 2012)。Yang等(2013)发现HT (诃子鞣酸)在体外具有相当大的抗71型肠道病毒活性,在小鼠模型中通过抑制病毒复制有效降低死亡率,缓解临床症状。已经证明单宁酸对HIV-1的抑制作用通过作用于病毒逆转录酶(Tan et al . 1991),蛋白酶(Xu et al ., 2000),和整合酶(Au et al ., 2001)抑制HIV-1复制,或通过干扰gp41 sex-helix束形成(Liuet al . 2004)抑制HIV-1进入靶细胞。据报道,绿茶中的表没食子儿茶素具有抑制丙型肝炎病毒(HCV)进入的作用(Ciesek et al.,2011; Calland et al., 2012)。Liu等(2015a,b)发现单宁酸(HT)抑制HCV进入和细胞间传播,但不干扰细胞内HCV复制。三种HT (punicalagin punicalin andgeraniin)通过阻止cccDNA的形成和促进cccDNA的衰变,通过双重机制抑制乙肝病毒ccDNA的生成(Liu et al.,2016)。Ueda等(2013)发现来源于柿子的单宁酸(Diospyros kaki)能显著降低12种被测病毒的病毒感染性,而来源于绿茶、金合欢、五倍子的单宁酸只对部分病毒有效,蛋白质聚集似乎是柿子单宁酸抗病毒作用的基本机制。从E cava中分离的褐藻多酚对流感病毒神经氨酸酶(Ryu et al.,2011),猪流行性腹泻病毒(PEDV)和HIV-1 (Karadeniz et al.,2014)具有较强的抗病毒活性,其中猪流行性腹泻病毒是通过抑制病毒进入和/或病毒复制(Kwon et al., 2013)。从Eisenia biclis分离的PT对小鼠诺如病毒(Eom et al.,2015)和人类乳头状瘤病毒(Kim and Kwak, 2015)也有类似的抗病毒活性。
以上信息表明,单宁酸具有不同的抗病毒活性,取决于化学成分和结构。虽然单宁酸的抗病毒方式不能完全理解,但是目前获得的信息表明,抑制病毒吸附细胞,抑制病毒渗透进入细胞核和抑制病毒反转录酶可能是一些潜在的机制(Buzzini et al ., 2008),单宁酸作为天然抗病毒制剂用于动物和家禽行业需要体内的研究进一步探索。



