人心脏微血管内皮细胞的应用
发布日期:2020/11/27 10:41:01
背景[1-3]
人心脏微血管内皮细胞是人心脏组织分离提取,提取纯化之后立即冻存,属代冻存细胞通过vWF/Factor VIII和CD31(P-CAM)免疫荧光染色验证,经测试不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
内皮细胞也称血管内皮细胞,通常指衬于心、血管和淋巴管内表面的单层扁平上皮,它形成血管的内壁。它们具有吞噬异物、细菌、坏死和衰老的组织,还参与机体免疫活动功能。
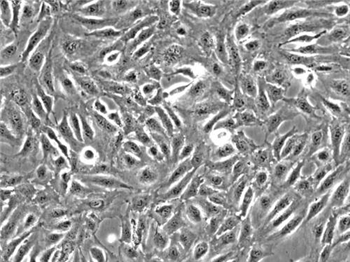
用高倍镜观察肠系膜上的毛细血管,可见到内皮细胞,内皮细胞较间皮细胞小,排列紧密。内皮细胞或血管内皮是一薄层的专门上皮细胞,由一层扁平细胞所组成。它形成血管的内壁,是血管管腔内血液及其他血管壁(单层鳞状上皮)的接口。内皮细胞是沿着整个循环系统,由心脏直至最小的微血管。心室内表面的内皮细胞称为心内膜。微血管及淋巴微管是由单一层的内皮细胞所组成。
内皮细胞通过分泌内皮源性血管收缩因子和内皮源性血管舒张因子,调节和降解血管活性肽以及内皮细胞表面的酶,达到进一步调节血管张力的功能。这些功能在不同的部位,不同器官的血管,以及大循环和微循环之间均存在着不同。
人心脏微血管内皮细胞对于心肌细胞的功能同时具有生理和病理的效应。它通过分泌NO、内皮素-1、前列腺素、腺苷酸嘌呤、利钠肽以及其它的物质调节心肌细胞的功能。
研究发现该效应在体内和体外培养都存在。CMEC也具有酶活性,特别是ACE/激肽酶活性,此酶活性能够调节心脏内局部血管紧张素II和缓激肽的水平。
应用[4][5]
用于自噬对缺氧诱导心脏微血管内皮细胞间质转分化和梗死后心肌纤维化的调控及机制研究
研究缺氧对人心脏微血管内皮细胞(human cardiac microvascular endothelial cells,HCMECs)间质转分化(endothelial-to-mesenchymal transition,EndMT)及自噬的影响;研究自噬对缺氧诱导的HCMECs EndMT的影响及具体机制。
方法:1、探究缺氧状态下对HCMECs EndMT的影响。
实验主要分为2组
(1)control组:常氧(21%O2、5%CO2、74%N2,37℃)条件下培养HCMECs3天;
(2)hypoxia组:缺氧(1%O2、5%CO2、74%N2,37℃)条件下培养HCMECs3天,分别对两组细胞进行如下实验:⑴光学显微镜下观察两组细胞形态学变化;
⑵RT-PCR测定各组细胞中CD31、E-cadherin、αSMA、FSP-1及Snail mRNA相对表达水平;
⑶Western blot测定两组细胞CD31、E-Cadherin、ɑSMA、FSP-1、Snail蛋白表达水平;
⑷双重免疫荧光染色观察CD31、αSMA及FSP-1表达变化及并对CD31+αSMA+/FSP+双阳性细胞(说明正在发生EndMT的细胞)和CD31-SMA+/FSP+细胞(说明已经发生EndMT的细胞)计数分析。
2、探究缺氧状态下HCMECs自噬水平的变化。⑴HCMECs缺氧3天内LC3蛋白的表达动态变化,通过Western blot法测定HCMECs缺氧0,2,4,6,12,24,48,72 h处LC3表达变化;
⑵将细胞分为以下4组:control组:常氧条件下培养HCMECs;氯喹(Chloroquine,CQ)(20μm)组:常氧条件下加入氯喹处理HCMECs 8小时;
hypoxia组:缺氧条件下培养HCMECs 6小时;hypoxia+CQ(20μm)组:常氧条件用氯喹处理HCMECs 2小时,缺氧培养6小时;Western blot法分别测定各组LC3表达变化;转染GFP-LC3质粒的HCMECs在缺氧3天内GFP-LC3表达动态变化,通过激光共聚焦观察HCMECs缺氧0,2,6,12,24,36,48,72 h处GFP-LC3表达变化。
参考文献
[1]Mechanical control of cardiac myofibroblasts[J].Sander van Putten,Yousef Shafieyan,Boris Hinz.Journal of Molecular and Cellular Cardiology.2015
[2]Autophagy induction impairs migration and invasion by reversing EMT in glioblastoma cells[J].Myriam Catalano,Giuseppina D’Alessandro,Francesca Lepore,Marco Corazzari,Sara Caldarola,Cristina Valacca,Fiorella Faienza,Vincenzo Esposito,Cristina Limatola,Francesco Cecconi,Sabrina Di Bartolomeo.Molecular Oncology.2015(8)
[3]Repetitive stimulation of autophagy-lysosome machinery by intermittent fasting preconditions the myocardium to ischemia-reperfusion injury[J].Rebecca J Godar,Xiucui Ma,Haiyan Liu,John T Murphy,Carla J Weinheimer,Attila Kovacs,Seth D Crosby,Paul Saftig,Abhinav Diwan.Autophagy.2015(9)
[4]Autophagic adaptations in diabetic cardiomyopathy differ between type 1 and type 2 diabetes[J].Hiromitsu Kanamori,Genzou Takemura,Kazuko Goto,Akiko Tsujimoto,Atsushi Mikami,Atsushi Ogino,Takatomo Watanabe,Kentaro Morishita,Hideshi Okada,Masanori Kawasaki,Mitsuru Seishima,Shinya Minatoguchi.Autophagy.2015(7)
[5]邹晋.自噬对缺氧诱导心脏微血管内皮细胞间质转分化和梗死后心肌纤维化的调控及机制[D].南昌大学,2017.
欢迎您浏览更多关于bio-73542的相关新闻资讯信息