吲哚,酮和烯烃一锅法合成取代咔唑
发布日期:2018/9/3 11:25:11
在过去几十年中,串联合成吸引了众多科研工作者的关注,它为一锅法制备C-C和C-Het键提供了理论依据。咔唑类化合物作为一类重要的化学原料,在药物化学和材料科学中使用非常广泛。目前,人们已广泛使用一锅串联合成的方法合成多取代咔唑。而在早期阶段,咔唑合成主要依赖于多步Fischer-Borsche方法合成。近年来,过渡金属(TM)催化分子内交叉偶联合成咔唑的方法已吸引了科学家的兴趣。在钯催化剂的存在下,芳基卤化物和2-卤代苯胺或1,2-二卤代芳烃可以先原位形成二芳基胺,然后偶联得到产物。在高温下,使用过量的膦,亚磷酸盐或一氧化碳,通过2-硝基联芳基的Cadogan环化,该方法为合成取代咔唑提供了另外一条路径。最近也有一些文献报道,在无过渡金属参与和温和的反应条件下,通过2-硝基联芳基和PhMgBr来合成取代咔唑。
吲哚-咔唑策略非常简洁,例如,通过多步Diels-Alder反应,吲哚和烯烃或炔在过渡金属催化作用下,π电子扩充,一步形成三个C-C键(Scheme 1a)。作者课题组以前在吲哚模板合成开展了大量工作,他们推测以易得的吲哚,酮和烯烃三组分为原料,可以串联合成制备咔唑类化合物:酮和吲哚先脱水缩合原位形成3-乙烯基吲哚,再与烯烃发生常规的[4 + 2]环加成形成四氢咔唑中间体,然后脱氢芳构化得到目标咔唑类化合物(Scheme 1b)。
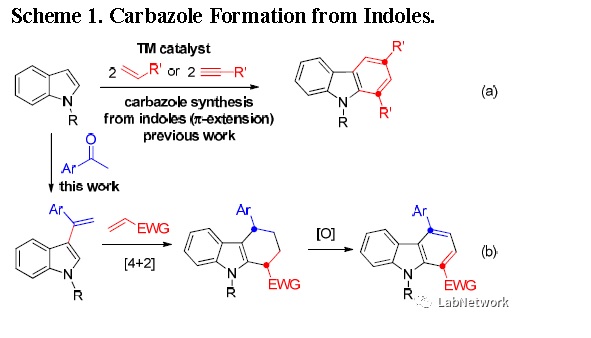
新方法引入
最近,作者发现在硝基苯乙烯与NH4I催化系统作用下,基于吲哚的三组分反应制备咔唑。特别是以硝基苯乙烯3a为原料,高产率得到不含硝基的咔唑4a(Scheme 2a),而丙烯酸丁酯(3b)为原料,在初始实验中,尽管在氧气氛下进行且延长反应时间,得到的产物主要是四氢咔唑4b(Scheme 2b)。作者推测脱氢芳构化可以在含氧的系统下一锅进行。
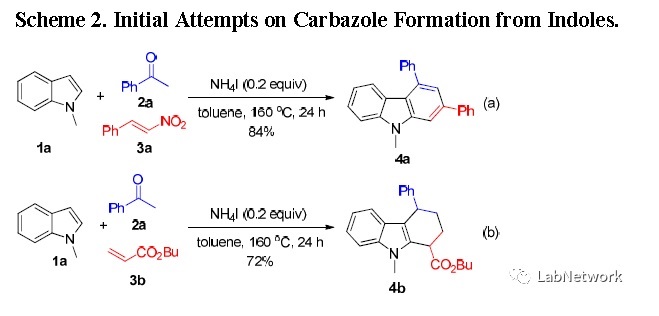
条件筛选
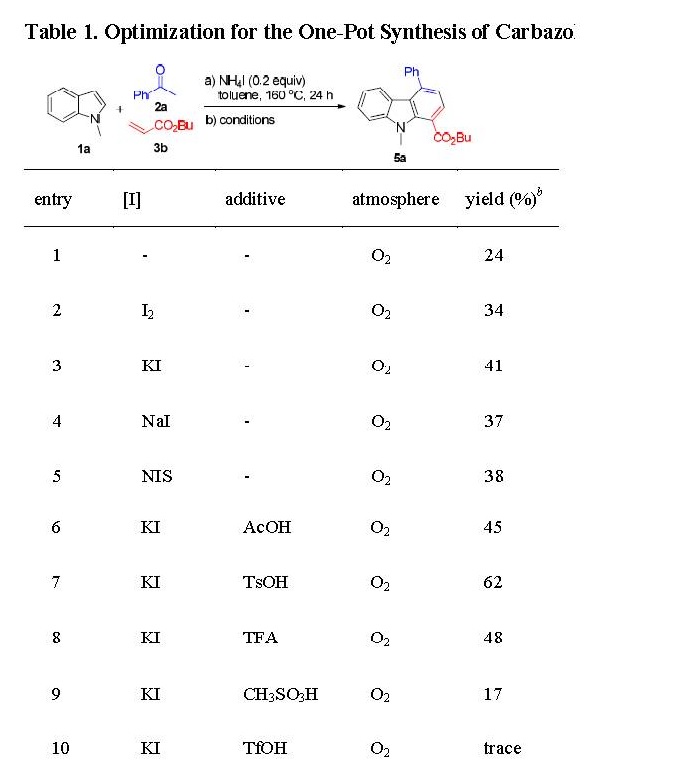
因此,作者使用氧作为唯一的氧化剂,对促进脱氢过程条件进行一系列筛选(Table 1)。通过简单地延长在氧气下的反应时间(entry 1),咔唑5a的产率提高至24%,这表明脱氢可以在有氧条件下实现。考虑到含碘试剂也具有氧化性,作者对一系列碘试剂如单质碘,KI,NaI和NIS(N-碘琥珀酰亚胺)筛选(entries 2-5),表明单质碘(entry 2)和KI(entry 3)可以提高5a的产率。接着,作者推测Brφnsted酸作为添加剂可以促进反应进行。在选取的酸(entries 6-10)中,TsOH效果(entry 7)。增加KI和TsOH的量可以进一步提高5a的产率到89%(entry 11)。若在空气气氛下进行该反应,目标产物的产率非常低(entry 12)。作为对比,在步中使用过量的NH4I来代替NH4I和KI的组合对于串联咔唑的合成效果很差。最后,降低反应温度,作者检测到一定量的过渡态四氢咔唑4b(entry 13,14)。因此,160℃的反应温度是脱氢步骤的充分必要条件。
底物拓展
在优化好的反应条件下,作者对成环/芳构化底物进行拓展(Table 2)。通常,N-烷基吲哚和N-芳基吲哚可以以较好收率得到相应的产物(5a-5c)。当N-甲基吲哚上引入不同取代基,像烷基,C5,C6或C7上引入卤素等,咔唑产物5d-5h的收率适中。不幸的是,当C4位上引入甲基,没有得到目标产物(5i)。
为了进一步检查该方法的适用范围和局限性,作者对含酮底物的范围进行了拓展(Table 3)。当含有卤素(F,Cl和Br),硝基,腈,砜等基团时,中等到良好产率得到相应的咔唑(6a-6k)。取代酮的空间效应影响可以通过氯代苯乙酮来解释。以1-(2-氯苯基)乙酮为底物,产率相对较低(61),但取代基处于对位的底物却可以高收率得到相应的咔唑6c。令作者高兴的是1-(萘-2-基)乙酮和1-(噻吩-2-基)乙酮底物在该条件下也能反应,得到相应的咔唑6m和6n,产率分别为61%和56%。其他芳香酮反应活性低。例如:底物苯丙酮的GC产率小于20%,底物1,2-二苯基乙酮得到相应的产物6p的收率为37%。接着对芳香酮、脂肪族酮底物进行拓展。通常,脂族酮为底物,其产物的收率较低(7a-7d)。如环己酮底物,得到相应的产物7e的收率小于20%,但发现大量的四氢咔唑副产物。
接着,作者选取一系列吸电子烯烃按照两步一锅法合成咔唑(Scheme 3)。 当使用丙烯酸乙酯时,作者发现收率随着丙烯酸乙酯用量的增加而增加。例如,在标准反应条件下(2当量丙烯酸乙酯),目标产物的收率为42%,而当丙烯酸乙酯的用量增加到4.0当量时,目标产物的收率为60%。产率不同的结果可归因于底物沸点低(99.8℃),而反应温度却高得多(160℃)。同时,作者发现使用丙烯酸正己酯得到73%收率(与正丁基丙烯酸酯为底物时76%收率相似)。丙烯腈为底物,产物8c的产率适中。二甲基富马酸盐也在该反应体系中起作用,得到咔唑8d,产率为45%。不幸的是,当使用肉桂酸甲酯时,不能获得相应的咔唑产物。
出乎意料的是,当使用丙烯酸,丙烯酸叔丁酯和丙烯酸环己酯,反应中容易发生脱羧,从而得到相同的咔唑产物9(Scheme 4a)。虽然N-甲基吲哚反应良好,但N-苄基吲哚,N-异丙基吲哚和N-Boc吲哚仅得到N-H咔唑10,苄基,异丙基和Boc基团在该反应条件下会脱除。但其产率比来自N-H吲哚的产率高得多(Scheme 4b)。意料之外的是,在该条件下,N上含酰基,嘧啶-2-基和磺酰基等取代基的缺电子吲哚得不到N-保护咔唑或N-H咔唑产物(Scheme4b)。
该反应条件使用密封管,同时用氧气作为唯一的氧化剂,在非常高的温度下实现咔唑合成,同时也造成该方法的局限性,在放大合成时缺乏实用性。为了解决这个问题,尝试使用除氧以外的氧化剂,在室温下氧化脱氢(Scheme 5)。作者使用2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ)为氧化剂,以58%的收率得到咔唑。且缩小反应规模到5 mmol时,使用DDQ为氧化剂,也能适中收率得到目标产物。对于其它氧化剂,如Dess-Martin试剂可以得到36%的产率,而1,4-苯醌(BQ)或过硫酸钾(K2S2O8)对反应一点影响都没有。
为了进一步阐明该方法的合成利用价值,对6d的进一步转化进行研究(Scheme 6)。钯催化条件下,6d与咔唑的交叉偶联得到含有两个咔唑母核的加合物11,产率中等,这表明可以将该方法应用到某些光电材料的合成。
机理探索
对于该反应机理,步是脱水缩合,得到四氢咔唑中间体4b。接着碘试剂参与脱氢过程,该过程可能是单电子氧化途径。如Scheme 7所示,氮中心自由基A形成单电子氧化形式的四氢咔唑,经历单电子位移得到中间体B。进一步单电子氧化和B的去质子化得到中间体C,其进一步通过去质子化和互变异构产生二氢咔唑D。中间体D经过第二次单电子氧化脱氢,再经过中间体E,F和G发生,得到最终产物5a。
总结
总结,本文开发了一种三组分经过先后二步一锅法合成取代咔唑的新方法。该吲哚-咔唑策略过程先后经过串联缩合,[4+2]环化和脱氢芳构化。该合成方法的优点包括原料易得,无金属参与,高区域选择性和官能团兼容性。此外,分子氧作为唯一氧化剂参与脱氢过程。



