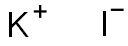-
外観
無色若しくは白色の結晶又は白色の結晶性の粉末
-
定義
本品は、次の化学式で表されるカリウム塩である。
-
性質
ヨウ化カリウムは無色の立方晶系結晶です。化学式はKI、式量は166.00で、密度は3.13g/cm3、融点は681℃、沸点は1,330℃です。水溶液中では電離しており、カリウムイオンとヨウ化物イオンになっています。
ヨウ化カリウムは、水・アルコール・・に溶けますが、エーテルには難溶です。湿った空気中では潮解性を示します。ヨウ化カリウムは、水に溶解する際に、強く吸熱します。ヨウ化カリウムの水溶液は、中性または微アルカリ性です。
また、光や空気酸化によって、徐々にヨウ素が遊離します。黒ずむため、遮光して密栓し保存することが必要です。が存在するとヨウ素が遊離するので、この性質を滴定反応として幅広く利用されています。
ヨウ化カリウムにはヨウ素を溶かす性質もあり、放置すると酸化され、ヨウ素を遊離して黄色に変化します。溶解したヨウ素の構造は、三ヨウ化物イオン (I3−) です。ヨウ素ヨウ化カリウム溶液はヨウ素液とも呼ばれ、デンプン水溶液に加えた際にヨウ素デンプン反応を起こします。
-
溶解性
水に易溶 (24.4g/100ml), エタノールに可溶。水に極めて溶けやすく、エタノールにやや溶けにくい。
-
解説
ヨウ化カリウム,化学式KI。ヨードカリ,ヨウポツ(沃剝)と俗称される。天然には海水,かん(鹹)水などに含まれる。無色立方晶系結晶。塩化ナトリウム型構造,格子定数7.0655Å。比重3.13。融点680℃,沸点1330℃。気体におけるイオン対K+―I-の原子間距離は3.0478Å。水100gに対する溶解度127.5g(0℃),208g(100℃)。エチルアルコール,メチルアルコール,アセトン,グリセリンに溶け,エーテルには難溶。
-
用途
写真薬、有機合成原料、分析用試薬、オキシダント測定用、飼料添加物 (化学工業日報社)
-
用途
オキシダント測定用吸収液調製用。
-
用途
汎用試薬。
-
用途
医薬品、製剤原料。
-
用途
写真製版用、医薬原料
-
応用
ヨウ化カリウムは残留塩素の測定に利用されます。ジエチルパラフェニレンジアミン法 (N,N-diethyl-p-phenylenediamine method) と呼ばれ、DPD法と略される場合もあります。
の検出に用いるネスラー試薬 (英: Nessler's reagent) に使用されるほか、第三級アミンやアルカロイドの検出に使われるドラーゲンドルフ試薬 (英: Dragendorff's reagent) の調製にも利用されています。
参考文献
-
効能
抗真菌薬, 去痰薬, ヨウ素補充薬
-
特長
普通品に比し長期間の保存でもブロッキング起こりにくく、サラサラとして取り扱いやすい。
-
商品名
ヨウ化カリウム (マイラン製薬); ヨウ化カリウム (小堺製薬); ヨウ化カリウム (小堺製薬); ヨウ化カリウム (山善製薬); ヨウ化カリウム (日医工); ヨウ化カリウム (日医工); ヨウ化カリウム (日医工); ヨウ化カリウム (日興製薬)
-
使用上の注意
湿った空気中でわずかに潮解する。
-
化学的特性
Potassium iodide is a white crystals, granules, or powder; strong, bitter, saline taste. becomes yellowish when exposed to bright light due to photochemical decomposition liberating traces of free iodine. Soluble in water, alcohol, acetone, and glycerol. slightly soluble in ether and ammonia. It may be prepared bythe reaction of iodine with hot potassiumhydroxide solution followed by separation from the iodate (which isalso formed) by fractional crystallization. In solution it has the interestingproperty of dissolving iodine to formthe triiodide ion I3-, which is brown. Potassium iodide is widely used as ananalytical reagent, in photography,and also as an additive to table salt toprevent goitre and other disordersdue to iodine deficiency.

-
天然物の起源
Potassium iodide is found in seaweed. Some important applications of this compound involve its use in pharmaceuticals and as a source of iodine in food,especially in animal and poultry feed. Potassium iodide is added to table salt to provide iodine in human food.
Another major use is in making photographic emulsions. In analytical chemistry, potassium iodide is used in iodometric titration with starch indicator to analyze dissolved oxygen, dissolved chlorine, sulfide, and other analytes in water.
-
使用
Potassium Iodide is a source of iodine and a nutrient and dietary supplement. it exists as crystals or powder and has a solubility of 1 g in 0.7 ml of water at 25°c. it is included in table salt for the preven- tion of goiter.Potassium Iodide is used primarily used in the treatment of radiation poisoning due to environmental contamination by iodine-131. It is also manufacture of photographic emulsions; in animal and poultry feeds to the extent of 10-30 parts per million; in table salt as a source of iodine and in some drinking water; also In animal chemistry. In medicine,potassium iodide is used to regulate the thyroid gland.
-
主な応用
Potassium iodide was first used as the primary halide in Talbot’s calotype process, then in the albumen on glass process followed by the wet collodion process. It was also used as a secondary halide in silver bromide gelatin emulsions, animal feeds, catalysts, photographic chemicals, and for sanitation. Potassium iodide is produced by reaction of potassium hydroxide with iodine. The product is purified by crystallization from water. Potassium iodide is ionic compound which iodine ions and silver ions can form yellow precipitate silver iodide (when exposes to light, it can decompose, it can be used to make high-speed photographic film), silver nitrate can be used to verify the presence of iodine ions.
-
製造方法
Potassium iodide is made by absorption of iodine in potassium hydroxide:
I2 + 6KOH → 5KI + KIO3 + 3H2O
Most potassium iodate, KIO3 , is separated from the product mixture by crystallization and filtration. Remaining iodates are removed by evaporation of the solution and other processes, such as carbon reduction or thermal decompostion at 600oC to iodide:
2KIO3 → 2KI + 3O2
Another method of preparation that does not involve the formation of iodate is by treating iron turnings with iodine solution. The product, ferrosoferric iodide, Fe3I8?16H2O, is boiled with 15 wt% potassium carbonate solution:
Fe3I8.16H2O + 4K2CO3 → 8 KI + 4CO2 + Fe3O4 + 16H2O
A similar method is used to prepare potassium bromide, discussed earlier (see Potassium Bromide.)
Potassium iodide can be prepared by reacting hydriodic acid with potassium bicarbonate:
HI + KHCO3 → KI + CO2 + H2O
It is purified by melting in dry hydrogen.
Potassium iodide also may be obtained by various electrolytic processes.
-
定義
ChEBI: Potassium iodide is a metal iodide salt with a K(+) counterion. A compound that contains pentavalent iodine, which is usually ionically bound to electropositive atoms. It is a scavenger of hydroxyl radicals. It has a role as a radical scavenger and an expectorant. It contains an iodide. It is a type of iodine that is not radioactive and can be used to help block one type of radioactive material, radioactive iodine (I-131), from being absorbed by the thyroid.
-
一般的な説明
Potassium iodide is an odorless white solid. Sinks and mixes with water. (USCG, 1999)
-
空気と水の反応
Water soluble.
-
反応プロフィール
Bromine trifluoride rapidly attacks the following salts: barium chloride, cadmium chloride, calcium chloride, cesium chloride, lithium chloride, silver chloride, rubidium chloride, potassium bromide, potassium chloride, Potassium iodide, rhodium tetrabromide, sodium bromide, sodium chloride, and sodium iodide [Mellor 2, Supp. 1:164, 165. 1956].
-
健康ハザード
May irritate eyes or open cuts.
-
化学性质
融点723℃,沸点1330℃
-
使用用途
ヨウ化カリウムは、各種ヨウ素化合物の原料や飼料添加物、ナイロン強化剤、写真乳剤、スマートフォンやパソコンの液晶用偏光フィルム、化学品の反応触媒など、幅広い用途にわたって用いられています。
医薬品分野では、抗真菌薬や去痰薬、ヨウ素補充薬などに使用される他、慢性関節炎・慢性リウマチ・神経痛・梅毒などの治療にも利用されることがあります。さらに、ヨウ化カリウムはオキシダント測定で使われるヨウ化カリウムデンプン紙という形で外部指示薬として、次亜塩素酸酸化還元滴定に用いられるなど、分析用試薬としても使用可能です。
-
予防薬
ヨウ化カリウムは甲状腺腫による甲状腺機能亢進症の治療に使用されており、ヨウ素を補給することが可能です。福島原発事故の後に、正式に放射性ヨウ素の内部被曝予防薬としての効能が承認されました。
原子力災害などで放射性ヨウ素を吸入すると、β崩壊によって内部被曝を起こしやすいです。そして甲状腺癌や甲状腺機能低下症といった晩発的な障害の危険性が高くなります。そこで、非放射性のヨウ化カリウムの製剤として使用すると消化管から吸収され、24時間以内にその10~30%が甲状腺に有機化合物として蓄積されます。
したがって、甲状腺内はヨウ素の安定同位体で満たされ、以後のヨウ素の取り込みを阻止し、放射線障害を予防することが可能です。後から取り込まれた過剰なヨウ素は、すぐに尿中へ排出されます。さらに、放射性ヨウ素の吸入後でも、8時間以内ならおよそ40%、24時間以内ならおよそ7%の取り込み阻害効果が認められています。
-
薬物動態学
Potassium Iodide is a metal halide composed of potassium and iodide with thyroid protecting and expectorant properties. Potassium iodide can block absorption of radioactive iodine by the thyroid gland through flooding the thyroid with non-radioactive iodine and preventing intake of radioactive molecules, thereby protecting the thyroid from cancer causing radiation. In addition, this agent acts as an expectorant by increasing secretion of respiratory fluids resulting in decreased mucus viscosity.
-
臨床応用
Potassium iodide is used to treat the cutaneous lymphatic
form of sporotrichosis, although newer agents
are also effective in this disorder and may be better tolerated tolerated.
The drug is also used for erythema nodosum and
nodular vasculitis.
-
安全性プロファイル
Poison by intravenous
route. Moderately toxic by ingestion and
intraperitoneal routes. Human teratogenic
effects by ingestion: developmental
abnormalities of the endocrine system.
Experimental teratogenic and reproductive
effects. Mutation data reported. Explosive
reaction with charcoal + ozone,
trifluoroacetyl hypofluorite, fluorine
perchlorate. Violent reaction or ignition on
contact with dazonium salts, diisopropyl
peroxydicarbonate, bromine pentafluoride,
chlorine trifluoride. Incompatible with
oxidants, BrF3, FClO, metaltic salts, calomel.
When heated to decomposition it emits very
toxic fumes of K2O and I-. See also
IODIDES.
-
合成方法
ヨウ化水素酸と炭酸水素カリウムを水素気流中で反応させる
-
純化方法
Crystallise it from distilled water (0.5mL/g) by filtering the near-boiling solution and cooling. To minimise oxidation to iodine, the process can be carried out under N2 and the salt is dried under a vacuum over P2O5 at 70-100o. Before drying, the crystals can be washed with EtOH or with acetone followed by pet ether. It has also been recrystallised from water/ethanol. After 2 recrystallisations, ACS/USP grade had Li and Sb at <0.02 and <0.01 ppm respectively. [Lingane & Kolthoff Inorg Synth I 163 1939.]