EHA105(pSoup)感受态细胞的应用
发布日期:2020/10/18 17:56:53
背景[1-7]
EHA105(pSoup)感受态细胞由EHA101菌株改造而来,为C58型背景,核基因中含有筛选标签——利福平抗性基因rif,为了便于转化操作,此菌株携带一无自身转运功能的琥珀碱型Ti质粒pEHA105(pTiBo542DT-DNA),此质粒含有vir基因(vir基因是T-DNA插入植物基因组必需的元件,pEHA105(pTiBo542DT-DNA)质粒自身的T-DNA转移功能被破坏,但可以帮助转入的双元载体T-DNA顺利转移)。在EHA105菌株中转入help质粒:pSoup即为EHA105(pSoup)菌株,可帮助pGreen,62SK,pGs2系列质粒在农杆菌中复制,同时赋予该菌株四环素(tet)抗性,适用于水稻、烟草等植物的转基因操作。
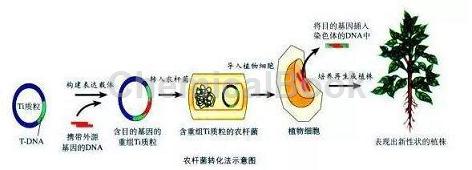
操作方法(采用冻融法):
1.取-80℃保存的农杆菌感受态于室温或手心片刻待其部分融化,处于冰水混合状态时插入冰中。
2.每100μl感受态加入0.01-1μg质粒DNA(转化效率较高,次使用前做预实验确定所加质粒的量),用手拨打管底混匀,依次于冰上静置5分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟。
3.加入700μl无抗生素的LB或YEB液体培养基,于28℃振荡培养2~3小时。
4.6000 rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素的LB或YEB平板上,倒置放于28℃培养箱培养2-3天(当平板只含有50μg/ml kan时,28℃培养48 h即可;平板中同时加入50μg/ml kan,20μg/ml rif时,需28℃培养60 h;如果使用的平板含有50μg/ml rif则需要28℃培养72-90 h)。
注意事项:
1.加入质粒时体积不应大于感受态体积的1/10;质粒不纯或存在乙醇等有机物污染,转化效率急剧下降;质粒增大一倍,转化效率下降一个数量级。
2.转化高浓度的质粒可相应减少最终用于涂板的菌量,本公司生产的GV3101(pSoup)化学转化感受态细胞具有四环素抗性,但在转入目标质粒涂板筛选阳性克隆时,只需加入目标质粒抗性的抗生素,不加四环素。
3.平板上阳性克隆密度过大时,由于营养不足,阳性克隆生长变慢,菌落变小,为了获得大的菌落,应减少质粒用量。
4.利福平浓度不应高于25μg/ml,过高的利福平浓度不利于农杆菌生长,会降低其生长速度和转化效率。
5.培养基中加入利福平的目的是防止杂菌生长、筛选农杆菌;根据所用菌株抗性加入链霉素或庆大霉素可防止Ti质粒丢失,但链霉素不利于农杆菌的转基因操作,培养农杆菌时不考虑链霉素或庆大霉素,Ti质粒丢失的概率极低(可以忽略)。
应用[7][8]
EHA105(pSoup)感受态细胞可用于甘蔗遗传转化技术研究:
农杆菌介导转基因方法由于所转入的外源基因拷贝数少、遗传稳定等优点,一直是科学工作者重点研究的方法。甘蔗是转基因安全等级最高的作物之一,但迄今尚未建立稳定的农杆菌介导转基因技术体系。本研究以商业化生产的含gus基因质粒pCAMBIA2301为载体,在用模式作物烟草测试五种农杆菌菌株EHA105、LBA4404、AGL1、GV3101和A281侵染能力的前提下,分别以五个甘蔗品种ROC22、FN15、FN28、FN30、FN39为受体材料,分愈伤组织、心叶、悬浮细胞三种靶组织类型,对5种农杆菌菌株介导的遗传转化方法进行了一系列优化。
主要研究结果如下:
1.烟草测试结果证明:五种农杆菌工程菌株EHA105/pCAMBIA2301、LBA4404/pCAMBIA2301、AGL1/pCAMBIA2301、GV3101/pCAMBIA2301和A281/pCAMBIA2301均具有侵染能力;所用侵染体系适合五种农杆菌工程菌株的侵染试验;
2.甘蔗愈伤组织遗传转化方法优化实验结果显示农杆菌侵染具有种属特异性,其中以甘蔗品种ROC22侵染效率最高,达到71%;侵染条件为愈伤组织诱导25d,在分化培养基上预培养6d,侵染前在含有500μmol/L乙酰丁香酮(AS)的MS培养液中浸泡6h,EHA105农杆菌液OD600为1.0,侵染液为MS+葡萄糖68.5g/L+精氨酸174mg/L+谷氨酰胺876mg/L+30g/L蔗糖+AS100μmoI/L,pH5.4,侵染50min,共培养5d,共培养温度为25℃时,有利于甘蔗胚性愈伤的遗传转化;FN15用GV3101/pCAMBIA2301和FN30用EHA105/pCAMBIA2301也得到一定的侵染效率,FN39在所有处理中很难侵染。
参考文献
[1]Improvement of Agrobacterium-mediated transformation of embryogenic calluses from maize elite inbred lines[J].Aifang Yang,Chunmei He,Kewei Zhang.In Vitro Cellular&Developmental Biology-Plant.2006(3)
[2]Transformation of Actinidia eriantha:A potential species for functional genomics studies in Actinidia[J].Tianchi Wang,Yidong Ran,Ross G.Atkinson,Andrew P.Gleave,Dan Cohen.Plant Cell Reports.2006(5)
[3]Successful Agrobacterium-Mediated Genetic Transformation of Maize Elite Inbred lines[J].Xueqing Huang,Zhiming Wei.Plant Cell,Tissue and Organ Culture.2005(2)
[4]High-frequency plant regeneration through callus initiation from mature embryos of maize(Zea Mays L.)[J].X.-Q.Huang,Z.-M.Wei.Plant Cell Reports.2004(11)
[5]Agrobacterium tumefaciens-mediated transformation of Festuca arundinacea(Schreb.)and Lolium multiflorum(Lam.)[J].A.Bettany,S.Dalton,E.Timms,B.Manderyck,M.Dhanoa,P.Morris.Plant Cell Reports.2003(5)
[6]Transformation and expression of a gene for herbicide resistance in a Brazilian sugarcane[J].M.C.Falco,A.Tulmann Neto,E.C.Ulian.Plant Cell Reports.2000(12)
[7]Somaclonal variation in insect‐resistant transgenic sugarcane(Saccharum hybrid)plants produced by cell electroporation[J].Ariel D.Arencibia,Elva R.Carmona,Maria T.Cornide,Stefano Castiglione,JoséO’Relly,Antonio Chinea,Pedro Oramas,Francesco Sala.Transgenic Research.1999(5)
[8]Herbicide-resistant sugarcane(Saccharum officinarum L.)plants by Agrobacterium-mediated transformation[J].Gil A.Enríquez-Obregón,Roberto I.Vázquez-Padrón,Dmitri L.Prieto-Samsonov,Gustavo A.De la Riva,Guillermo Selman-Housein.Planta.1998(1)
[9]蔡澜峰.根癌农杆菌介导甘蔗遗传转化技术研究[D].福建农林大学,2010.
欢迎您浏览更多关于EHA105(PSOUP)感受态细胞的相关新闻资讯信息
