外泌体micRNA相关基因PCR检测服务
发布日期:2020/3/31 8:49:10
背景[1-7]
外泌体micRNA相关基因PCR检测服务是运用荧光定量PCR技术对细胞外泌体micRNA相关基因的种类及丰度的检测服务。外泌体(Exosome)是由细胞分泌而来的微小囊泡,直径约为30-100 nm,具有杯状形态、双层膜结构,天然存在于血液、尿液、唾液、母乳和细胞培养基等生物体液中。包括肿瘤细胞在内几乎所有类型的细胞(免疫细胞、神经细胞、干细胞),都可以产生并释放exosome。
Exosome可通过细胞膜受体直接激活受体细胞,也可运输蛋白质、mRNA、miRNA、lncRNA、circRNA,甚至细胞器进入受体细胞,参与细胞间通讯。Exosome在免疫应答、炎症反应、血管生成、凋亡、凝血和废物处理等生理过程发挥关键作用,可作为多种疾病的早期诊断标记物,也能作为靶向药物的载体进行疾病治疗。
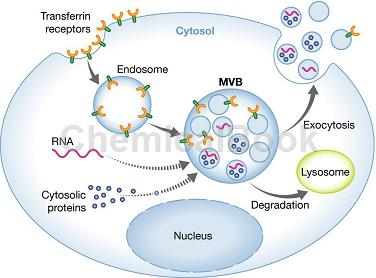
miRNA是一类22nt左右大小的非编码分子,它可以通过外泌体从一个地方转运到另外一个地方行使基因沉默功能。通过检测外泌体中miRNA表达变化,可以发现外泌体中miRNA特异性功能。外泌体(Exosomes)广泛分布于唾液、血浆、乳汁、尿液等体液中。它是具有脂质双层膜结构的微小膜泡,大小为30-150nm左右。外泌体可以携带丰富的RNA、DNA、蛋白质等物质在细胞和组织之间自由穿梭,参与细胞间的通讯网络。外泌体广泛参与了机体免疫应答、抗原呈递、细胞分化、肿瘤生长于侵袭等多种生物过程。
外泌体是指包含了复杂RNA和蛋白质的小膜泡(30-150nm)。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。
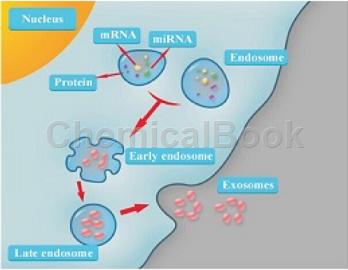
所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等方方面面。有研究表明肿瘤来源的外泌体参与到肿瘤细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了肿瘤的生长与侵袭。
应用[8][9]
外泌体micRNA相关基因PCR检测服务可用于外泌体介导的乳腺癌细胞增殖和转移的作用机制研究:
mi R-193b在多种肿瘤细胞的生长过程中发挥着重要的抑制作用,并且与患者的临床病理特征和预后联系紧密。RAB22A是原癌基因RAS家族的成员,在外泌体的形成,运输和代谢中起重要作用,并且与多种人类癌症的发生和发展有关,但其在乳腺癌中具体的作用机制仍不清楚。外泌体是由细胞产生并分泌至细胞外的微囊泡,依靠其内含有的特殊递质成分在细胞之间传递特殊的生物信号,从而影响到肿瘤细胞的生长能力。
在本文中我们将通过检测细胞与组织中RAB22A基因与mi R-193b的表达水平,明确在不同样本中二者表达水平间的相互关系;探讨调控RAB22A表达对乳腺癌细胞增殖、迁移及侵袭的作用及与mi R-193b的关系;研究RAB22A基因所介导的外泌体产生与发挥功能在乳腺癌细胞生长中所起到的作用。这些研究可能对乳腺癌的靶向治疗方式的选择具有一定意义。
方法:检测RAB22A与mi R-193b的表达:收集242例浸润性乳腺癌患者的组织,以及乳腺癌细胞MCF-7、MDA-MB-231、SK-BR-3、MDA-MB-453、MDA-MB-468、ZR-75、T47D和乳腺上皮细胞MCF-10A,通过RT-q PCR及免疫蛋白印迹实验,检测RAB22A与mi R-193b的表达水平及相对关系。此外,用免疫组织化学技术分析这部分患者癌组织内RAB22A的表达水平,探讨其与患者年龄、临床分期、组织学分级、肿瘤大小、淋巴结转移情况等乳腺癌预后影响因素间的关系。利用Kaplan-Meier生存曲线评价高表达RAB22A基因对患者预后的影响能力。
建立低表达RAB22A基因的细胞模型:分别建立mi R-193b过表达的MCF-7和SK-BR-3细胞模型,利用RT-q PCR检测实验组与对照组细胞中mi R-193b的表达,证实转染效果;同时观察过表达mi R-193b后对于RAB22A的影响。在过表达mi R-193b的细胞中转染去除了mi R-193b结合位点的pc DNA3.1-RAB22A或pc DNA3.1,观察转染细胞的生长情况,证实RAB22A与mi R-193b的调节关系;使用克隆有HBLV-RAB22A sh RNA-Puro(sh RAB22A)的慢病毒感染MCF-7和SK-BR-3细胞,HBLV-Scramble-Puro control(SC)用于阴性对照,利用RT-q PCR及免疫蛋白印迹实验证实RAB22A基因的敲减效果。
参考文献
[1]Suresh Mathivanan,Hong Ji,Richard J.Simpsonet al.Exosomes:Extracellular organelles important in intercellular communication Journal of proteomics 7 3(2010)1907–1920
[2].Richard J Simpson†,Justin WE Lim,Robert L Moritz andSuresh Mathivanan et al.E xosomes:proteomic insightsand diagnostic potential.Expert Rev.Proteomics 6(3),267–283(2009)
[3]Hadi Valadi,Karin Ekström1,Apostolos Bossios,Margareta Sjöstrand1,James J.Lee and Jan O.Lötvall et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells.Nat Cell Biol 2007;9:654–9.
[4]Andersen JS,Mann M.Organellar proteomics:turning inventories into insights.EMBO Rep 2006;7:874–9.
[5]Piccin A,Murphy WG,Smith OP.Circulating microparticles:pathophysiology and clinical implications.Blood Rev 2007;21:157–71.
[6]del Conde I,Shrimpton CN,Thiagarajan P,Lopez JA.Tissue-factor-bearing microvesicles arise from lipid rafts and fuse with activated platelets to initiate coagulation.Blood 2005;106:1604–11.
[7]Ratajczak J,Wysoczynski M,Hayek F,Janowska-Wieczorek A,Ratajczak MZ.Membrane-derived microvesicles:important and underappreciated mediators of cell-to-cell communication.Leukemia 2006;20:1487–95.
[8]Mears R,Craven RA,Hanrahan S,Totty N,Upton C,Young SL,Patel P,Selby PJ,Banks RE.Proteomic analysis of melanomaderived exosomes by two-dimensional polyacrylamide gel electrophoresis and mass spectrometry.Proteomics 2004;4:4019–31.
[9]孙亮.miR-193b靶向RAB22A基因调节外泌体介导的乳腺癌细胞增殖和转移的作用机制研究[D].吉林大学,2018.
欢迎您浏览更多关于外泌体MICRNA相关基因PCR检测服务的相关新闻资讯信息
