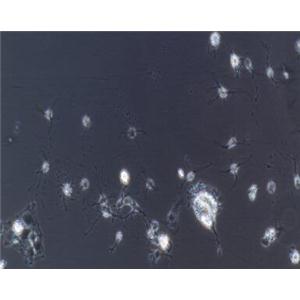
小鼠海马神经元细胞的注意事项
发布日期:2020/2/18 7:59:45
背景及概述[1-2]
海马椎体神经元是海马区的主要成分,主要功能是参与近期记忆、情绪及内脏功能调节、是老年性痴呆、癫痫等疾病的主要病灶之一。小鼠海马神经元细胞培养是研究神经细胞生物学特性和外源干扰因素作用(细胞因子)的有效细胞模型,其在神经生物学,发育生物学体外实验研究中已被广泛应用。
传代培养[1-2]
传代前准备--胰蛋白酶消化--吹打分散细胞--分装稀释细胞--继续培养
1)将培养瓶内旧的培养液弃掉,然后用D-Hanks液洗两次,(一定要洗干净,以免影响胰酶的消化作用)。
2)加入0.25%胰酶-EDTA消化,25cm培养瓶加0.4ml,37度消化5min,镜下看到细胞变圆,间隙增大。
3)立即加含10%FCS的培养液终止消化,用细胞刮刀轻刮,注意,这时候用吸管吹不下来,但是刮刀却很容易刮下来,而且对细胞的损伤极小。
4)离心,弃上清,加新的培养液(10%FCS),小心吹匀,分装入新的培养瓶。

注意事项[1-2]
1、不要轻易改变培养液,我曾经把MEM换成1640后,细胞传几代后莫名其妙死亡。
2、如果想节省消化液,上面第2步可换成3-5mlDPBS洗,主要是去除培养瓶里会影响消化液作用的成分。
3、自配消化液一定要调PH(=7.8-8)值,并且注意分装,-20度保存,避免反复冻融,用前37度预热,消化较好较快。
4.严格的无菌操作。
5.适度消化:消化的时间受消化液的种类、配制时间、加入培养瓶中的量等诸多因素的影响,消化过程中应该注意培养细胞形态的变化,一旦胞质回缩,连接变松散,或有成片浮起的迹象就要立即终止消化。
相关研究[1-2]
有研究观察枸杞多糖对HT22细胞缺糖缺氧再灌注损伤的影响。方法:构建HT22细胞缺糖缺氧再灌注损伤模型,设正常组、模型组、枸杞多糖100,50和25mg·L-1组,检测细胞存活率;并通过HE染色观察形态学改变;检测细胞内SOD,GSH-PX,MDA,T-AOC;利用流式细胞术检测线粒体膜电位。结果:枸杞多糖100和50mg·L-1组能明显提高细胞存活率,显著改善缺氧缺糖再灌注损伤引起的形态改变;可显著提高细胞内SOD,GSH-PX及T-AOC,减少MDA的产生;改善线粒体膜电位下降。结论:枸杞多糖能够显著减轻缺糖缺氧再灌注损伤引起的HT22细胞过氧化损伤。
此外,有研究探索十溴联苯醚(PBDE-209)诱导小鼠海马神经元细胞凋亡的潜在机制。方法原代海马神经元细胞和海马神经元细胞系HT-22用0、6.25、12.5、25、50和100μg/mLPBDE-209处理24h。检测原代海马神经元细胞SOD活性,MDA、NO和GSH的含量,用AnnexinV/PI双染法检测海马神经元细胞系HT-22细胞凋亡情况,用免疫蛋白印迹Westernblot检测Bax、Bcl-2、CHOP、GRP78、PERK和Caspase-12蛋白表达水平。结果染毒组原代海马神经元细胞和HT-22细胞系细胞存活率显著降低(P<0.05)。原代海马神经元细胞MDA、NO含量显著升高(P<0.05),GSH含量、SOD活性显著降低(P<0.05);原代海马神经元细胞的Bax/Bcl-2比值、CHOP、Caspase-12蛋白表达水平升高(P<0.05)。HT-22细胞系GRP78、PERK、Caspase-12表达水平和细胞凋亡率升高(P<0.05)。结论氧化应激和内质网应激可能参与PBDE-209诱导的海马神经元细胞凋亡过程。
主要参考资料
[1] 枸杞多糖对小鼠海马神经元细胞系缺糖缺氧再灌注损伤的影响
[2] 十溴联苯醚诱导小鼠海马神经元细胞氧化应激和凋亡的机制
欢迎您浏览更多关于小鼠海马神经元细胞的相关新闻资讯信息