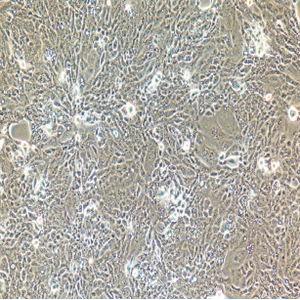
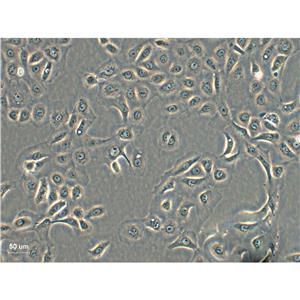
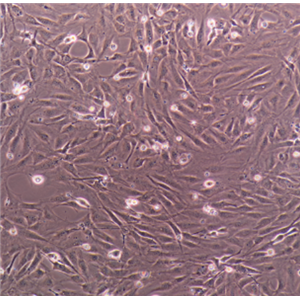
人肾小管上皮细胞的应用
发布日期:2024/4/9 9:11:45
背景[1-3]
人肾小管上皮细胞是从人类肾脏内皮细胞中分离出的一类多能性干细胞,可以分化为多种不同类型的细胞,包括肾小管上皮细胞、内皮细胞、平滑肌细胞等。这些细胞具有较高的增殖能力和特异性表型,因此被广泛应用于肾脏疾病研究和药物筛选等领域。
在肾脏疾病研究中,人肾小管上皮细胞可以用于模拟肾脏疾病发生的过程,评估药物的毒性和疗效。例如,通过将人肾小管上皮细胞与不同浓度的药物共培养,可以观察到细胞的变化和损伤程度,从而评估药物对肾脏的影响。此外,人肾小管上皮细胞还可以用于研究肾脏疾病的发病机制,如肾小球肾炎、糖尿病肾病等。
在药物筛选领域,人肾小管上皮细胞可以用于评估药物的肾脏毒性和代谢情况。由于肾脏是药物代谢和排泄的主要器官之一,因此评估药物对肾脏的影响对于药物的安全性和有效性至关重要。通过使用人肾小管上皮细胞进行体外实验,可以快速准确地评估药物的肾脏毒性和代谢情况,为药物研发提供重要的支持。
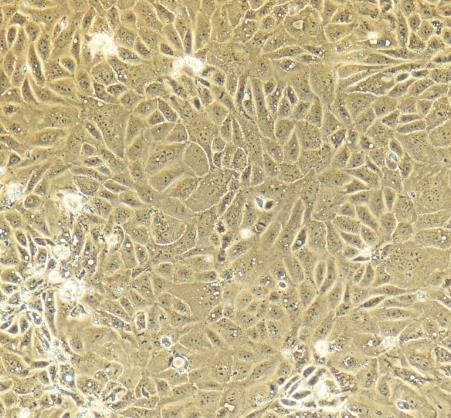
人肾小管上皮细胞
人肾小管上皮细胞培养操作
1)复苏人肾小管上皮细胞:以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀。在1000 rpm条件下离心3 min,弃去上清液,加1-2 mL培养基后吹匀。然后将所有细胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入10 cm皿中,加入约8 mL培养基,培养过夜)。第二天换液并检查细胞密度。
2)人肾小管上皮细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1 mL消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,使消化液浸润所有细胞,弃去消化液,将培养瓶置于37℃培养箱中消化1 min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
c、按6-8 mL/瓶补加培养基,轻轻打匀后装入无菌离心管中,1000 rpm离心4 min,弃去上清液,补加1-2 mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
3)人肾小管上皮细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4-5]
人肾小管上皮细胞可以用于STAT3调控的自噬在血管紧张素Ⅱ诱导的肾小管上皮细胞衰老过程中的作用及氯沙坦对其的影响
研究血管紧张素II诱导的肾小管上皮细胞衰老过程中STAT3通路、自噬参与的调控作用和机制,并观察应用血管紧张素II受体拮抗剂氯沙坦在改善肾小管上皮细胞衰老过程中的作用和机制,并在小鼠体内进行验证,以期为延缓肾脏衰老、慢性肾脏病防治提供策略。
研究方法:1.建立血管紧张素Ⅱ诱导的人肾小管上皮细胞衰老模型并观察自噬在其衰老过程中的变化及对衰老的影响。应用10-6mol/L浓度的Ang II作用于人HK-2细胞0h至72h,采用流式细胞术检测细胞周期、Western blot法检测衰老相关蛋白P21表达水平、衰老相关β-半乳糖苷酶染色(SAβ-gal)检测衰老细胞阳性率方法以建立人肾小管上皮细胞衰老模型。此后应用Ang II、3-MA作用于人HK-2细胞,并应用Western blot法检测自噬相关蛋白LC3II、P62、衰老相关蛋白P21表达水平、电镜检测自噬体数量、LC3-GFP-m RFP自噬双标腺病毒转染及激光共聚焦显微镜观察自噬光斑数量、SAβ-gal检测衰老细胞阳性率,以观察Ang II诱导的人肾小管上皮细胞自噬的变化及对衰老的影响。2.调控STAT3通路并观察其在血管紧张素Ⅱ诱导的人肾小管上皮细胞衰老过程中的作用及氯沙坦干预对人肾小管上皮细胞STAT3通路、自噬、衰老的影响。
应用Ang II诱导人肾小管上皮细胞衰老,使用Western blot法检测STAT3/PI3KC3通路变化,并应用S3I-201药物阻断及si RNA-STAT3基因阻断STAT3并应用Western blot法观察p STAT3蛋白、PI3KC3蛋白、衰老相关蛋白P21、自噬相关蛋白LC3II、P62表达水平、电镜检测自噬体数量,LC3-GFP-m RFP自噬双标腺病毒转染观察自噬光斑数量、β-半乳糖苷酶染色检测衰老细胞阳性率等指标。在Ang II诱导人肾小管上皮细胞衰老过程中应用氯沙坦处理人HK-2细胞,并应用Western blot法观察p STAT3、P21、LC3II、P62表达水平、电镜检测自噬体数量,LC3-GFP-m RFP自噬双标腺病毒转染观察自噬光斑数量、SAβ-gal染色检测衰老细胞阳性率等方法观察氯沙坦对HK-2细胞STAT3通路、自噬、衰老的影响及作用。
结果:1.血管紧张素Ⅱ诱导人肾小管上皮细胞衰老过程中自噬活性增强并介导其衰老。10-6mol/L浓度的Ang II作用于人HK-2细胞,CCK-8法结果显示Ang II 0-72h促进人HK-2细胞增殖,此后抑制细胞增殖;细胞周期检测发现Ang II作用于人HK-2细胞72h后超过80%的细胞进入G0-G1期,显著高于正常对照组;Western blot结果显示,与正常对照组相比,人HK-2细胞衰老相关蛋白P21表达水平呈时间依赖性增加,72h时P21蛋白表达水平显著高于正常对照组;SAβ-gal染色发现,与正常对照组相比,人HK-2细胞β-半乳糖苷酶染色细胞阳性率呈时间依赖性增加,48h、72h时与对照组相比均显著增加,72小时达最高值。
参考文献
[1]Senolytic therapy ameliorates renal fibrosis postacute kidney injury by alleviating renal senescence.[J].Li Caizhen;Shen Yanting;Huang Liuwei;Liu Chongbin;Wang Jun.FASEB journal:official publication of the Federation of American Societies for Experimental Biology,2021
[2]Senescence and the Aging Immune System as Major Drivers of Chronic Kidney Disease.[J].Schroth Johannes;Thiemermann Christoph;Henson Siân M.Frontiers in cell and developmental biology,2020
[3]Accelerated Kidney Aging in Diabetes Mellitus.[J].Jing Guo;;Hui Juan Zheng;;Wenting Zhang;;Wenjiao Lou;;Chenhui Xia;;Xue Ting Han;;Wei Jun Huang;;Fan Zhang;;Yaoxian Wang;;Wei Jing Liu;;Gianna Ferretti.Oxidative medicine and cellular longevity,2020
[4]Benefits of Metformin in Attenuating the Hallmarks of Aging[J].Ameya S.Kulkarni;;Sriram Gubbi;;Nir Barzilai.Cell Metabolism,2020
[5]李慧敏.STAT3调控的自噬在血管紧张素Ⅱ诱导的肾小管上皮细胞衰老过程中的作用及氯沙坦对其的影响[D].中国医科大学,2022.
欢迎您浏览更多关于人肾小管上皮细胞的相关新闻资讯信息