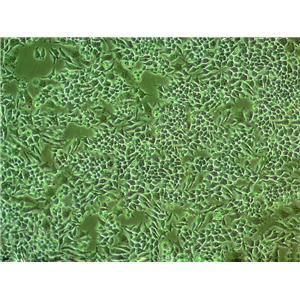
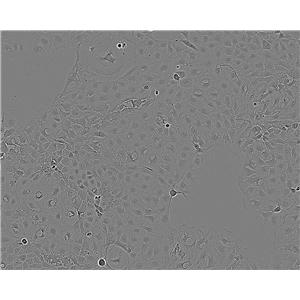
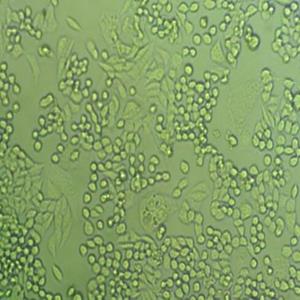
TE-13 人食管癌细胞系的应用
发布日期:2023/11/9 8:53:19
背景[1-3]
TE-13人食管癌细胞系是一种来源于人类食管鳞状细胞癌的细胞系。它最初是由日本国立癌症中心(NHC)于1970年代从一名患有食管癌的女性体内分离出来的。
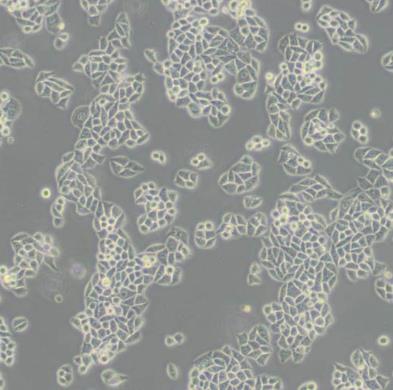
TE-13人食管癌细胞系
TE-13人食管癌细胞系的特点包括:
贴壁生长:TE-13细胞系可以在含有血清的培养基中贴壁生长,形成单层或多层的细胞群落。
异质性:TE-13细胞系具有较高的异质性,即不同克隆的细胞在形态、生长速度和基因表达等方面存在差异。
耐药性:TE-13细胞系对多种化疗药物具有耐药性,这使得它成为研究食管癌耐药机制的重要工具。
基因突变:TE-13细胞系中存在多个已知的致癌基因突变,如TP53、EGFR等。这些突变可能与该细胞系的恶性转化有关
TE-13人食管癌细胞系细胞培养方法:
1、TE-13人食管癌细胞系细胞传代:细胞密度达到80-90%时即可传代
①弃去培养上清,用PBS或生理盐水清洗1-2次;
②加入2ml0.25%胰酶(T25瓶),使胰酶覆盖整个瓶或皿,盖好放入培养箱消化;
③1-2min后,显微镜下观察细胞,若大部分细胞回缩且有少量细胞脱落,轻轻吹打下确认消化情况后加入*培养基终止消化;若细胞还是贴壁,放回培养箱继续消化至可以轻轻吹打下为止;
④将细胞悬液1000RPM左右条件下离心4min,弃上清;
⑤用新鲜培养基重悬后加入培养瓶或皿中,T25培养瓶加6-8ml培养基;
⑥悬浮细胞直接离心收集,细胞沉淀重悬后分到新培养瓶中。
2、TE-13人食管癌细胞系细胞复苏:
①将冻存管在37℃温水中快速摇晃融化,时间1min左右,加入4-5ml培养基混匀。
②在1000RPM左右条件下离心4min,弃上清,加1-2ml培养基吹匀,将细胞悬液加入培养瓶中,补加适量培养基。
3、TE-13人食管癌细胞系细胞冻存:待细胞生长状态良好时进行细胞冻存保种
①弃去培养上清,用PBS或生理盐水清洗1-2次,加入1mL 0.25%胰蛋白酶(T25瓶)
②1-2min后,显微镜下观察细胞,大部分细胞回缩且有少量细胞脱落,轻轻吹打下确认消化情况后加入*培养基终止消化;
③将细胞悬液1000RPM左右条件下离心4min,弃上清,加1ml冻存液重悬细胞;
④将冻存管放入程序降温盒,放入-80℃冰箱,4小时后将冻存管转入液氮罐储存。
应用[4-5]
TE-13人食管癌细胞系可以用于双氢青蒿素对人食管癌细胞TE-13的体外作用及其机制的实验研究
通过体外实验研究DHA对人食管癌细胞株TE-13的增殖抑制作用和对细胞周期和凋亡以及Survivin、Caspase-3蛋白表达的影响,进一步探讨DHA对TE-13人食管癌细胞系细胞的作用及其相关机制,从而为食管癌的中医中药治疗提供相应的理论依据。
方法:1细胞培养后,应用普通光学显微镜观察DHA作用于人食管癌细胞株TE-13后细胞的形态学变化。
2不同浓度的DHA作用于人食管癌TE-13细胞后,应用四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)比色法测定细胞光密度值(opticaldensity,OD),计算生长抑制率,研究DHA对人食管癌细胞株TE-13细胞增殖的影响。
3应用流式细胞仪技术(flow cytometry,FCM)研究DHA对人食管癌细胞株TE-13凋亡率的影响。
4应用流式细胞技术检测DHA对TE-13人食管癌细胞系细胞周期分布影响。5应用免疫细胞化学(immunocytochemistry,IC)方法定性检测DHA作用于人食管癌细胞TE-13后,凋亡相关基因Survivin、Caspase-3蛋白的表达变化。
结果:1.DHA对TE-13细胞形态的影响普通光学显微镜下观察未经药物处理的TE-13细胞贴壁生长,分布均匀,形态呈菱形或多边形,大小一致,细胞透明,形态饱满,胞体折光性好。而经过DHA处理48h后的实验组细胞形态发生明显的变化,细胞数目减少,体积缩小,细胞胞浆中出现空泡,细胞核固缩,脱落细胞数量明显增加,胞体折光性减弱。
2.DHA对TE-13人食管癌细胞系细胞增殖的抑制作用MTT比色法显示,不同浓度DHA对TE-13细胞有明显的体外增殖抑制作用。给予不同浓度的DHA(10、20、40、80、160μmol/l)处理TE-13细胞24h、48h、72h显示,各加药组OD值均有不同程度下降,抑制率呈不同程度的升高,与对照组相比,差异具有统计学意义(p<0.05)。并且随着药物浓度的不断增加、作用时间的不断延长,OD值逐渐下降,抑制率逐渐升高。由此可见,DHA对TE-13细胞的增殖抑制作用呈现明显的剂量-时间效应关系。
3.DHA对TE-13人食管癌细胞系细胞凋亡率的影响流式细胞仪检测细胞凋亡率结果显示,DHA可诱导TE-13细胞凋亡。给予浓度为40、80、160μmol/l的DHA作用于TE-13细胞48h后,出现典型的亚二倍体凋亡峰,随着DHA浓度增大呈明显的升高趋势,低、中、高剂量加药组的凋亡百分率分别为:8.643%±0.126%、18.606%±0.776%、29.026%±0.730%,统计后提示各处理组较对照组有显著性统计学意义(p<0.05)。
4.DHA对TE-13人食管癌细胞系细胞周期分布的影响流式细胞仪检测细胞周期结果提示,DHA可阻滞TE-13细胞周期于G0/G1期,该作用在各加药组有明显的剂量依赖性。应用不同浓度DHA(40、80、160μmol/L)作用TE-13人食管癌细胞系细胞48h后,随药物浓度增加,药物组与对照组相比,G0/G1期细胞呈增多趋势,G2/M及S期细胞呈减少趋势,统计提示较对照组及药物组均有统计学意义(P<0.05)。
5.免疫细胞化学检测DHA对TE-13人食管癌细胞系细胞Survivin、Caspase-3蛋白表达的影响。免疫组化结果提示,DHA可以使Survivin表达减弱,Caspase-3蛋白表达升高。不同浓度DHA(40、80、160μmol/L)作用后,经阳性细胞百分比以及阳性细胞染色程度两方面分析,加药组Survivin蛋白表达值(IHS值)随药物浓度增加,逐渐降低,各加药组和对照组相比有显著性差异(p<0.01)。加药组Caspase-3的表达值(HIS值)随药物浓度增加,逐渐升高;各加药组和对照组相比有显著性差异(p<0.01)。
参考文献
[1]Prodrug cancer gene therapy.Cestmir Altaner.Cancer Letters,2008
[2]Dihydroartemisinin induces apoptosis in human leukemia cells HL60 via downregulation of transferrin receptor expression.Hui-Jun Zhou;;Zeng Wang;;Ao Li.Anti-Cancer Drugs,2008
[3]Effects of sustained antiangiogenic therapy in multistage prostate cancer in TRAMP model..Isayeva Tatyana;;Chanda Diptiman;;Kallman Lisa;;Eltoum Isam-Eldin A;;Ponnazhagan Selvarangan.Cancer research,2007
[4]Global cancer statistics,2002..Parkin D Max;;Bray Freddie;;Ferlay J;;Pisani Paola.CA:a cancer journal for clinicians,2005
[5]刘晓君.双氢青蒿素对人食管癌细胞TE-13的体外作用及其机制的实验研究[D].河北医科大学,2012.
欢迎您浏览更多关于TE-13 人食管癌细胞系的相关新闻资讯信息