大鼠肾小球系膜细胞的应用
发布日期:2023/10/12 11:40:01
背景[1-3]
大鼠肾小球系膜细胞分离自肾小球组织采用机械研磨法结合不同孔径不锈钢网筛过滤后使用胶原酶消化制备而来。
肾小球是肾脏的一个重要结构,负责过滤血液中的废物和多余的水分形成尿液。系膜则是一层覆盖在肾小球表面的纤维状组织,起到支持和连接的作用。
大鼠肾小球系膜细胞在生物医学研究中具有重要价值。由于大鼠与人在生物学上具有较高的相似性,因此大鼠肾小球系膜细胞可以作为研究人类肾小球疾病的模型。通过对大鼠肾小球系膜细胞的研究,可以帮助科学家们更好地了解肾脏疾病的发生机制、病理变化以及药物作用机制,为治疗相关疾病提供新的思路和靶点。
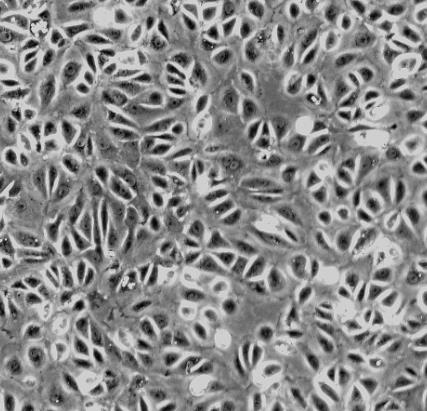
大鼠肾小球系膜细胞
在实验室中,研究人员通常会使用细胞培养技术来培养大鼠肾小球系膜细胞。首先,从大鼠体内获取肾脏组织,然后将组织切成小块,用酶进行消化,最后将细胞悬液接种到培养皿中。通过添加适当的培养基和生长因子,可以促进大鼠肾小球系膜细胞的生长和分裂。在适当的条件下,这些细胞会逐渐形成典型的“鹅卵石”状或“桑葚”状结构。
大鼠肾小球系膜细胞培养操作:
1)复苏大鼠肾小球系膜细胞:以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀。在1000 rpm条件下离心3 min,弃去上清液,加1-2 mL培养基后吹匀。然后将所有细胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入6 cm皿中,加入约4 mL培养基,培养过夜)。第二天换液并检查细胞密度。
2)大鼠肾小球系膜细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1 mL消化液(0.25%Trypsin-0.02%EDTA)于培养瓶中,使消化液浸润所有细胞,弃去消化液,将培养瓶置于37℃培养箱中消化1-3min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。c、按6-8 mL/瓶补加培养基,轻轻打匀后装入无菌离心管中,1000 rpm离心4 min,弃去上清液,补加1-2 mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
3)大鼠肾小球系膜细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
大鼠肾小球系膜细胞可以用于二甲双胍通过miR-124a-3p/AMPKα上调高糖环境培养下大鼠肾小球系膜细胞中的自噬水平
研究旨在探明二甲双胍对高糖下大鼠肾小球系膜细胞的作用,并深入探讨二甲双胍通过对高糖培养的大鼠肾小球系膜细胞中miR-124a-3p及AMPKα的调控影响自噬的作用,以期为DKD的发病机制的研究提供理论基础,为DKD的防治提供新的靶点。
研究方法:二甲双胍对T2DM SD大鼠肾小球病理改变的影响。雄性SD大鼠(SPF级)30只适应性喂养2周后,随机分成对照组10只,给予普通饲料喂养;其余20只大鼠高脂高糖饲料喂养。4周后,腹腔注射链脲佐菌素(STZ)30 mg/kg.BW。在连续注射3天后予以12小时禁食不禁水,检测空腹血糖(FBG)水平,空腹血糖>11.1mmol/L或随机血糖>16.7mmol/L作为DM造模成功的标准。造模成功的大鼠16只,随机抽取8只大鼠作为DM组(DM组),二甲双胍组(Met组)8只。Met组每日给予二甲双胍(250 mg/kg BW)灌胃,药物干预8周,DM组及NC组给予等量纯净水灌胃。
观察一般症状,记录大鼠体重以及各组大鼠的FBG。实验结束时,计算肾脏指数,大鼠的肾脏、肝脏组织固定制成石蜡切片,分别进行HE、D-PAS及Masson染色,观察其病理变化。肾脏切片孵育Lamp2及Tomm20蛋白荧光抗体,使用激光共聚焦显微镜观察其表达情况。免疫组化观察肾脏皮质中BECN-1和P62的表达情况。蛋白免疫印迹法观察Lamp2、BECN-1、P62、Atg-12、AMPKα和p-AMPKα蛋白的表达(分组同上)。
二甲双胍通过miR-124a-3p/AMPKα对高糖培养环境下的大鼠肾小球系膜细胞中自噬水平的调控作用。取5~9代对数生长期(HBZY-1)即大鼠肾小球系膜细胞株,细胞浓度为1×106个细胞接种于25cm2培养瓶中培养,40%~60%贴壁融合后同步化24h(用无血清MEM培养基),
分组处理:
(1)正常糖组(NG,5.5mmol/L葡萄糖),
(2) 渗透压对照组(HM,5.5mmol/L葡萄糖+24.5mmol/L甘露醇),
(3) 高糖组(HG,30mmol/L葡萄糖),
(4)HG转染miR-124a-3p inhibitor组(HG+miR-i),
(5)HG转染miR-124a-3p阴性对照组(HG+miR-NC),
(6)HG转染miR-124a-3p inhibitor组联合二甲双胍处理组:HG+miR-i+二甲双胍组(Metformin,Met),
(7)HG+二甲双胍对照组(HG+miR-NC+Met)。
二甲双胍处理高糖诱导下的大鼠肾小球系膜细胞,应用基因沉默技术干扰miR-124a-3p的表达;培养24h、48h、72h后RMC的增殖采用CCK-8试剂盒检测;使用Real-Time qPCR法检测细胞中miR-124a-3p的表达;采用Western Blot检测自噬相关蛋白Lamp2、BECN-1的表达以及AMPKα和p-AMPKα蛋白的表达。
结果:二甲双胍对2型糖尿病SD大鼠肾小球病理改变的影响。
1. 一般情况:二甲双胍可以缓解T2DM大鼠体重减轻(p<0.01)。
2. 糖代谢指标:二甲双胍能够降低T2DM大鼠的空腹血糖(FBG)水平(p<0.05).
3.肾脏指数:二甲双胍处理后,T2DM大鼠肾脏指数降低(p<0.01)。
参考文献
[1]Hydroxysafflor yellow A inhibits hypoxia/reoxygenation-induced cardiomyocyte injury via regulating the AMPK/NLRP3 inflammasome pathway.Jing-xue Ye;;Min Wang;;Rui-ying Wang;;Hai-tao Liu;;Yao-dong Qi;;Jian-hua Fu;;Qiong Zhang;;Ben-gang Zhang;;Xiao-bo Sun.International Immunopharmacology,2020
[2]Korean red ginseng attenuates hyperglycemia-induced renal inflammation and fibrosis via accelerated autophagy and protects against diabetic kidney disease.Shanika Karunasagara;;Geum-Lan Hong;;Se-Ra Park;;Na-Hyun Lee;;Da-Young Jung;;Tae-Won Kim;;Ju-Young Jung.Journal of Ethnopharmacology,2020
[3]Modulatory effect of metformin on cardiotoxicity induced by doxorubicin via the MAPK and AMPK pathways.Jiaoting Chen;;Sheng Zhang;;Guixuan Pan;;Lin Lin;;Dongying Liu;;Zhen Liu;;Song Mei;;Lijing Zhang;;Zhihang Hu;;Jianguo Chen;;Huaxing Luo;;Yin Wang;;Yanfei Xin;;Zhenqiang You.Life Sciences,2020
[4]Smad3 promotes AKI sensitivity in diabetic mice via interaction with p53 and induction of NOX4-dependent ROS production.Jia-Nan Wang;;Qin Yang;;Chen Yang;;Yu-Ting Cai;;Tian Xing;;Li Gao;;Fang Wang;;Xin Chen;;Xue-Qi Liu;;Xiao-Yan He;;Biao Wei;;Ling Jiang;;Chao Li;;Juan Jin;;Jia-Gen Wen;;Tao-Tao Ma;;Hai-Yong Chen;;Jun Li;;Xiao-Ming Meng.Redox Biology,2020
[5]刘宇.二甲双胍通过miR-124a-3p/AMPKα上调高糖环境培养下大鼠肾小球系膜细胞中的自噬水平[D].中国医科大学,2022.
欢迎您浏览更多关于大鼠肾小球系膜细胞的相关新闻资讯信息