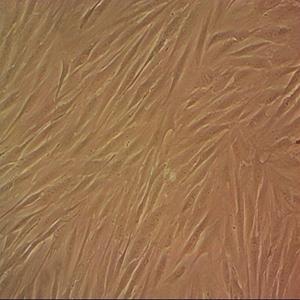
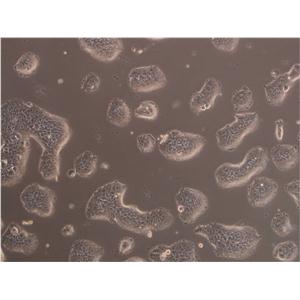
QGY-7701人肝癌贴壁细胞系的应用
发布日期:2023/8/25 15:34:04
背景[1-3]
QGY-7701人肝癌贴壁细胞系是从人肝癌组织中分离出来的一种细胞系,通常使用DMEM高糖培养基、10%胎牛血清和1%双抗。
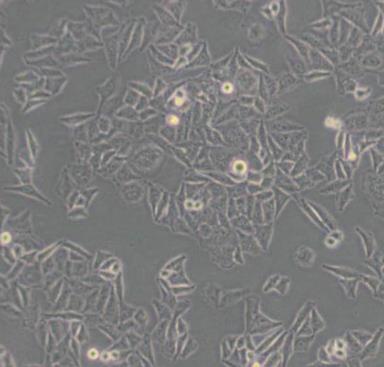
QGY-7701人肝癌贴壁细胞系
QGY-7701人肝癌贴壁细胞系细胞培养操作
1)复苏QGY-7701人肝癌贴壁细胞系细胞:以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀。在1000 rpm条件下离心3 min,弃去上清液,加1-2 mL培养基后吹匀。然后将所有细胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入10 cm皿中,加入约8 mL培养基,培养过夜)。第二天换液并检查细胞密度。
2)QGY-7701人肝癌贴壁细胞系细胞传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1 mL消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,使消化液浸润所有细胞,弃去消化液,将培养瓶置于37℃培养箱中消化1 min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
c、按6-8 mL/瓶补加培养基,轻轻打匀后装入无菌离心管中,1000 rpm离心4 min,弃去上清液,补加1-2 mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
3)QGY-7701人肝癌贴壁细胞系细胞冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4][5]
QGY-7701人肝癌贴壁细胞系可以用于LETM1通过AMPK调控Beclin-1/Bcl-2复合物解离参与肝癌细胞自噬和凋亡的机制研究
目的:1.分析LETM1在肝癌组织中的表达情况,探讨LETM1表达水平与临床病理参数及预后的关系;2.观察干扰LETM1对肝癌细胞增殖、凋亡和自噬表型的影响;3.探讨LETM1通过AMPK调控肝癌细胞凋亡与自噬的分子机制。方法:1.通过Oncomine数据库分析LETM1在肝癌组织及正常肝组织中的表达情况及其与预后的关系;采用q RT-PCR、WB进一步验证LETM1在临床标本的表达情况;免疫组织化学检测LETM1在配对肝癌组织及癌旁组织的表达情况,并根据免疫组化结果分析LETM1表达水平与肝癌患者临床病例资料及总体生存率的关系。
2.运用RNAi技术及慢病毒转染技术构建LETM1敲低的Huh7及QGY-7701稳转株;采用CCK8检测细胞存活率,PI染色检测细胞周期;利用Annexin V-FITC/PI双染色法、AO/EB双重荧光染色法检测细胞凋亡;运用免疫荧光检测自噬标记蛋白LC3的表达水平,透射电子显微镜观察细胞自噬小体;运用Western blot检测凋亡相关蛋白(p-Bcl-2、Bcl-2、Bax、caspase-3)以及自噬相关蛋白(Beclin-1、p62、LC3)的表达水平。
3.使用AMPK抑制剂,运用Western blot方法检测AMPK与p-AMPK、凋亡相关蛋白(p-BCL-2、BCL-2、Bax和Caspase-3)和自噬相关蛋白(Beclin-1、p62及LC3)在各组中的表达情况;Co-IP实验技术检测Beclin-1与Bcl-2之间的相互结合情况。
结果:1.Oncomine数据库分析结果显示:相较于正常肝组织,LETM1在肝癌组织中的表达增高,且LETM1高表达组患者总体生存期劣于低表达LETM1组患者;(2)q RT-PCR、Western blot及免疫组织化学检测结果显示:LETM1在肝癌组织中表达高于癌旁组织,且LETM1表达水平与肿瘤大小、门静脉癌栓和转移及TNM分期密切相关。(3)Kaplan-Meier分析结果显示:与低表达LETM1患者相较,LETM1高表达的HCC患者预后更差。
2.使用RNAi技术及慢病毒转染技术成功构建LETM1敲低的Huh7和QGY-7701肝癌细胞稳转株。
(2)CCK-8检测结果显示:sh-LETM1组细胞的增殖活性较sh-NC组均明显降低;流式细胞术检测细胞周期结果显示:与sh-NC组比较,sh-LETM1组细胞处于G0/G1期细胞比例均增多,而S期和G2/M期则均降低。
(3)Annexin V/PI双标与AO/EB双重荧光染色法检测细胞凋亡结果显示:与sh-NC组相比,sh-LETM1组的细胞凋亡均明显增高。
参考文献
[1]Autophagy in liver diseases:Time for translation?.Manon Allaire;;Pierre-Emmanuel Rautou;;Patrice Codogno;;Sophie Lotersztajn.Journal of Hepatology,2019
[2]Energy-dissipating hub in muscle mitochondria:Potassium channels and uncoupling proteins.Wieslawa Jarmuszkiewicz;;Adam Szewczyk.Archives of Biochemistry and Biophysics,2019
[3]Knockdown of LETM1 inhibits proliferation and metastasis of human renal cell carcinoma cells..Xu Jie;;Huang Bisheng;;Li Saiyang;;Zhang Xiaolu;;Xie Tiancheng;;Xu Yunfei.Oncology letters,2018
[4]Autophagy is a gatekeeper of hepatic differentiation and carcinogenesis by controlling the degradation of Yap..Lee Youngmin A;;Noon Luke A;;Akat Kemal M;;Ybanez Maria D;;Lee Ting-Fang;;Berres Marie-Luise;;Fujiwara Naoto;;Goossens Nicolas;;Chou Hsin-I;;Parvin-Nejad Fatemeh P;;Khambu Bilon;;Kramer Elisabeth G M;;Gordon Ronald;;Pfleger Cathie;;Germain Doris;;John Gareth R;;Campbell Kirk N;;Yue Zhenyu;;Yin Xiao-Ming;;Cuervo Ana Maria;;Czaja Mark J;;Fiel M Isabel;;Hoshida Yujin;;Friedman Scott L.Nature communications,2018
[5]周宝勇.LETM1通过AMPK调控Beclin-1/Bcl-2复合物解离参与肝癌细胞自噬和凋亡的机制研究[D].重庆医科大学,2022.
欢迎您浏览更多关于QGY-7701人肝癌贴壁细胞系的相关新闻资讯信息