HMC3的应用
发布日期:2023/5/29 8:52:27
背景[1-3]
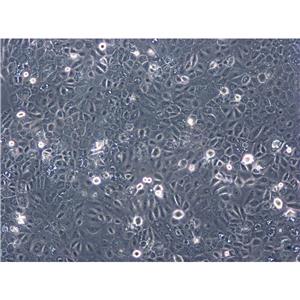
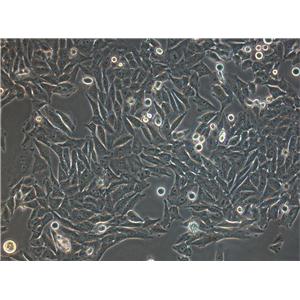
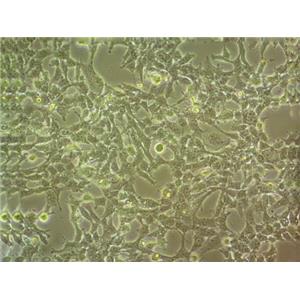
HMC3是通过人胎脑源性原代小胶质细胞培养物的SV40依赖性永生化建立的,静息HMC3细胞的小胶质细胞/巨噬细胞标志物IBA1呈强阳性,星形胶质细胞标志物GFAP呈阴性。
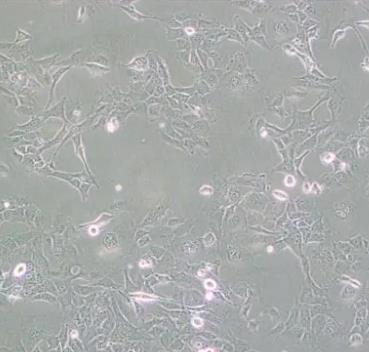
HMC3
HMC3传代步骤:
1吸出原培养液;
2加入2mL左右PBS,轻轻晃动培养瓶润洗HMC3细胞,吸出PBS丢弃;
3加入1mL左右胰酶,轻轻晃动培养瓶,使之浸润所有细胞;
4放入培养箱消化,消化2-3分钟,轻拍培养瓶侧壁,显微镜下看到细胞脱壁且聚集的细胞团松散开后,可终止;
5加入3mL含血清的培养基,终止消化,吹打细胞使之脱壁,并在液体里反复吹打,使细胞混匀为悬浮液,这时可以在显微镜观察;
6收集HMC3细胞悬液离心,1200rpm/min 3分钟,离心完吸出上清丢弃;
7加入新鲜培养基,吹打几下混匀细胞即可;按需接种到新培养瓶,补足培养基,拧松瓶盖或使用透气瓶盖进行培养;
8检查培养箱二氧化碳、温度和水盘。
HMC3换液步骤
1吸出旧HMC3培养基,用PBS进行润洗,然后加入新的HMC3培养基;
2每2~3天换液一次。
冻存HMC3步骤
1配制HMC3冻存液,冻存液推荐配比:55%(基础培养基DM/F12)+40%(血清)+5%(DMSO);
2 DMSO配制的时候会发热,一定要等冻存液冷却后使用,避免灼伤细胞;
3 HMC3细胞消化下来制成细胞悬液;
4 1200rpm 3分钟离心后去上清,尽量吸干净上清;
5加入配制好的冻存液重悬HMC3,建议一个T25长满,冻存1支,或者细胞计数后,按照3~5×106cells/支冻存;
6分装好的冻存液转入程序冻存盒,放入-80℃冰箱过夜;
7从-80℃冰箱取出冻存管,并迅速转移到液氮长期保存。
复苏HMC3步骤
1将水浴锅预热至37℃,准备好干净的一次性PE手套,向一个无菌离心管内加入5mL无菌培养基;
2将HMC3细胞从液氮罐中取出,放入PE手套中,迅速没入水浴锅,摇晃冻存管,使细胞快速溶解,以1分钟内全部溶解为宜;
3在超净台中,将复苏好的细胞液加入到装有新鲜培养基的离心管内,1200rpm/min离心3分钟,离心完毕去掉上清;
4取适量专用完全培养基重悬HMC3细胞,接入到无菌容器中(培养瓶或培养皿),补充培养基到适宜,放入培养箱培养;
5溶解过程要快,已溶解的冻存细胞在常温中尽量短时间存放,尽快离心去除DMSO。
应用[4][5]
HMC3可以用于紫杉醇氧化铁纳米粒子抑制胶质瘤及其机制的研究
制备并鉴定紫杉醇氧化铁纳米粒子(IONP@PTX),并探讨其对胶质母细胞瘤(Glioblastoma,GBM)的抑制作用及潜在机制。
方法:高温热解法及相转移法合成IONP@PTX,使用高效液相色谱仪及紫外分光光度计检测紫杉醇负载情况及其累积释放率,通过粒径分析、Zeta电位和透射电子显微镜(Transmission electron microscope,TEM)对IONP@PTX进行表征。通过CCK8试剂盒检测IONP@PTX或PTX作用于U251细胞或HMC3细胞后的细胞活力。
将PTX、IONP@PTX、IONP@PTX联合3-MA或IONP@PTX联合雷帕霉素作用于U251细胞,通过CCK8试剂盒检测细胞活力;通过划痕实验、Transwell迁移和侵袭实验检测细胞迁移和侵袭能力;利用2’-7’-二氯二氢荧光素二乙酸酯(DCFH-DA)或C11-BODIPY染色检测细胞内活性氧(Reactive oxygen species,ROS)和脂质过氧化水平;通过铁离子检测试剂盒检测细胞内的铁离子浓度;通过western blot实验检测自噬及铁死亡生物标志物的表达。
U251细胞皮下注射于裸鼠右前肢,建立人胶质瘤细胞移植瘤裸鼠模型,待肉眼可见成瘤后腹腔注射生理盐水、IONP@PTX、IONP@PTX联合3-MA或IONP@PTX联合雷帕霉素,监测肿瘤生长情况及裸鼠体重变化,治疗结束后剥离肿瘤,提取肿瘤组织蛋白检测铁死亡标志物的表达;同时取未接瘤裸鼠腹腔注射生理盐水、IONP@PTX、IONP@PTX联合3-MA或IONP@PTX联合雷帕霉素,治疗结束后取材测量各组裸鼠的肝脏和脾脏重量,计算肝脾指数,检测IONP@PTX对生物体的毒性作用。
结果:紫外-可见光吸收光谱分析结果表明PTX成功负载于IONP,载药量为1mg/ml IONP@PTX溶液包含273.5μg紫杉醇,且在12小时内从IONP@PTX快速释放。粒径分析及TEM结果表明IONP@PTX水合粒径约为36 nm,核心粒径约为10 nm,Zeta电位为-29±7.65 mV。
与PTX相比,IONP@PTX对HMC3细胞的毒性较小,而对U251细胞毒性较大;并能明显抑制U251细胞的迁移、侵袭能力,增加细胞内铁离子浓度、ROS和脂质过氧化水平,自噬相关蛋白Beclin1的表达水平显著升高,并且铁死亡相关蛋白GPX4的表达水平明显下降(P<0.05)。
体内实验表明,IONP@PTX明显抑制GBM移植瘤的生长,并降低肿瘤组织中GPX4蛋白的表达水平(P<0.05)。各组肝脾指数均无明显差异,说明IONP@PTX对GBM移植瘤裸鼠无明显的毒性作用。另外,体内外实验均表明,自噬抑制剂3-MA可明显降低IONP@PTX对GBM的抑制作用,而自噬促进剂雷帕霉素可明显增强抑制作用(P<0.05)。
结论:紫杉醇氧化铁纳米粒子通过诱导铁死亡抑制胶质母细胞瘤生长,且与自噬途径相关。
参考文献
[1]Therapeutic regulation of autophagy in hepatic metabolism[J].Katherine Byrnes;Sophia Blessinger;Niani Tiaye Bailey;Russell Scaife;Gang Liu;Bilon Khambu.Acta Pharmaceutica Sinica B,2022(01)
[2]Changing profiles of cancer burden worldwide and in China:a secondary analysis of the global cancer statistics 2020[J].Cao Wei;Chen Hong-Da;Yu Yi-Wen;Li Ni;Chen Wan-Qing.中华医学杂志英文版,2021(07)
[3]Research progress on the source,production,and anti-cancer mechanisms of paclitaxel[J].YANG Yan-Hua;MAO Jia-Wang;TAN Xiao-Li.Chinese Journal of Natural Medicines,2020(12)
[4]HM30181A,a potent P-glycoprotein inhibitor,potentiates the absorption and in vivo antitumor efficacy of paclitaxel in an orthotopic brain tumor model[J].Wu Zeng;Betty Yuen Kwan Law;Vincent Kam Wai Wong;Denise So Bik Chan;Simon Wing Fai Mok;Joyce Jia Ying Gao;Rebecca Ka Yan Ho;Xu Liang;Jia Hao Li;Ming Tsung Lee;Weng Li Yoon;Michael P Smolinski;Johnson Yiu Nam Lau;Christopher Wai Kei Lam;Manson Fok.Cancer Biology&Medicine,2020(04)
[5]陈汉仁.紫杉醇氧化铁纳米粒子抑制胶质瘤及其机制的研究[D].桂林医学院,2022.
欢迎您浏览更多关于HMC3的相关新闻资讯信息