重组大鼠IL-13
发布日期:2019/12/30 8:29:01
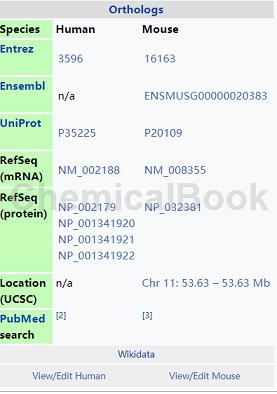
背景[1][2][3][4][5]
Recombinant Rat IL-13(重组大鼠IL-13)是将大鼠IL13基因通过基因克隆构建到工程菌中,通过大量扩陪诱导工程菌大量增值可大量生产IL13蛋白。白细胞介素13(IL-13)是一种蛋白质,在人中由编码IL13基因。
IL-13于1993年首次克隆,位于染色体5q31上,长度为1.4kb。它的质量为13 kDa,折叠成4个α螺旋束,IL-13的二级结构特征与白细胞介素4(IL-4)相似;然而,它仅与IL-4具有25%的序列同源性,并且能够进行IL-4非依赖性信号传导。IL-13是由T辅助2型(Th2)细胞分泌的细胞因子,CD4细胞,自然杀伤T细胞,肥大细胞,嗜碱性细胞,嗜酸性粒细胞和Nuocyte细胞。
白细胞介素-13是IgE合成,杯状细胞增生,粘液分泌过多,气道高反应性,纤维化和几丁质酶上调的中枢调节剂。它是过敏性炎症和不同疾病(包括哮喘)的中介。已知IL-13诱导造血细胞的变化,但这些效应可能不如IL-4重要。此外,IL-13可以诱导活化的人B细胞分泌免疫球蛋白E(IgE)。从小鼠中删除IL-13不会显着影响Th2细胞发育或由强效过敏原诱导的抗原特异性IgE反应。
相比之下,IL-4的缺失消除了这些反应。因此,IL-13不是淋巴细胞因子,而是作为将过敏性炎症细胞与与其接触的非免疫细胞连接起来的分子桥而更突出地起作用,从而改变生理功能。IL-13的信号传导通过与IL-4共享的多亚基受体开始。该受体是由αIL-4受体(IL-4Rα)和α白细胞介素-13受体(IL-13R1)组成的异二聚体受体复合物。IL-13对IL-13R1的高亲和力导致它们的键形成,这进一步增加了异二聚体形成IL-4R1和产生2型IL-4受体的可能性。异二聚化激活STAT6和IRS。STAT6信号传导在引发过敏反应中很重要。
IL-13的大部分生物学效应,如IL-4的生物学效应,与单一的相关转录因子,信号转导和转录激活因子6(STAT6)。白细胞介素-13及其与IL-4受体α亚基(IL-4Rα)相关的受体允许STAT6的下游活化。受体细胞质末端的JAK Janus激酶蛋白允许STAT6的磷酸化,然后STAT6形成活化的同型二聚体并被转运至细胞核。一旦在细胞核中,STAT6异二聚体分子调节细胞类型的基因表达,这对于宿主免疫防御和过敏性炎症反应(例如Th2的发展)之间的平衡至关重要。
这可能是由于面对Ala基因时引起的过敏反应。IL-13还与另一种称为IL-13Rα2的受体结合。IL-13Rα2(标记为诱饵受体)来源于Th2细胞,是一种多向免疫调节细胞因子。IL-13对IL-13Rα2的亲和力(50倍)大于对IL-13Ra1的亲和力(50倍)。IL-13Rα2亚基仅与IL-13结合,并且在小鼠中以膜结合和可溶形式存在。在人类受试者中未检测到可溶形式的IL-13Rα2。对具有IL-13Rα2无效基因座的IL-13转基因小鼠肺的研究表明,IL-13Rα2缺乏显着增加IL-13或卵清蛋白诱导的肺部炎症和重塑。
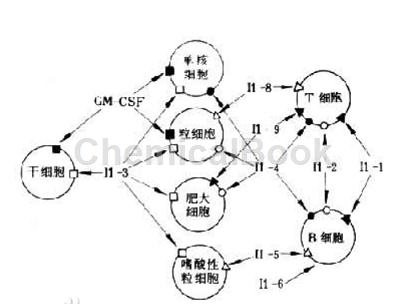
大多数正常细胞,如免疫细胞或内皮细胞,表达非常低或不可检测的IL-13受体水平。研究表明,与正常对照气道成纤维细胞的表达相比,IL-13Rα2在人哮喘气道成纤维细胞上的细胞表面表达降低。这支持了IL-13Rα2是IL-13诱导的反应的负调节因子的假设,并且说明了TGF-β1的产生和小鼠肺中胶原沉积的显着减少。
研究应用[6][7]
IL-13特异性地诱导驱除有害生物或其产物所需的寄生器官的生理变化。例如,从各种小鼠蠕虫的肠道中排出需要由Th2细胞分泌的IL-13。IL-13诱导肠道中的若干变化,其产生对寄生虫有害的环境,包括增强的收缩和来自肠上皮细胞的糖蛋白过度分泌,最终导致生物体从肠壁分离并将其移除。寄生虫曼氏血吸虫的卵可能存在于各种器官中,包括肠壁,肝脏,肺,甚至中枢神经系统,在IL-13的控制下诱导形成肉芽肿。然而,在这里,最终的结果是器官损伤,往往是深刻的甚至致命的疾病,而不是感染的解决方案。
一个新兴的概念是IL-13可能拮抗解决细胞内感染所需的Th1反应。在这种免疫失调的情况下,IL-13抑制宿主免疫细胞破坏细胞内病原体的能力,其特征在于异常大量Th2细胞的募集。已经证明IL-13表达在过敏原攻击后特应性轻度哮喘患者的支气管肺泡灌洗液(BAL)和细胞中增加。全基因组关联研究已经确定了IL-13的多种多态性和编码IL-13受体的基因与哮喘易感性,支气管高反应性和IgE水平升高相关。
IL-13的过度表达诱导过敏性肺病的许多特征,包括气道高反应性,杯状细胞化生,粘液分泌过多和气道重塑,这些都会导致气道阻塞。小鼠研究表明,IL-13既是必需的,也足以在小鼠肺中产生类似哮喘的Th2反应。IL-13主要在气道平滑肌束中的痰,支气管粘膜下层,外周血和肥大细胞中过表达。IL-4有助于这些生理变化,但不如IL-13重要。
IL-13还诱导趋化因子的分泌,所述趋化因子是将过敏效应细胞募集到肺部所需的。对STAT6转基因小鼠的研究表明,大多数这些效应都需要仅通过气道上皮发生IL-13信号传导。虽然还没有研究直接暗示IL-13在人类疾病的控制中存在许多多态性已经证明IL-13基因可以增加特应性呼吸系统疾病如哮喘的风险。在一项针对哮喘的敲除小鼠模型进行的研究中,仅发现空气阻力,粘液产生和促纤维化介质诱导依赖于IL-13R1而非IL-13Rα2的存在。
对体内转基因小鼠的研究表明,IL-13的肺过度表达诱导上皮下气道纤维化。IL-13是纤维化的毒素,感染,过敏和移植后细支气管炎闭塞症模型的主要效应物。其他研究表明,IL-13负责促进上皮细胞的存活和迁移,通过气道上皮细胞产生诱导型一氧化氮合酶,激活巨噬细胞,上皮细胞的通透性,以及将气道成纤维细胞转化为肌成纤维细胞。导致胶原蛋白沉积。沉积然后影响哮喘患者的气道重塑。
参考文献
[1] Rael EL,Lockey RF(2011)."Interleukin-13 signaling and its role in asthma".The World Allergy Organization Journal.4(3):54–64.doi:10.1097/WOX.0b013e31821188e0.PMC 3651056.PMID 23283176.
[2] Zurawski G,de Vries JE(January 1994)."Interleukin 13,an interleukin 4-like cytokine that acts on monocytes and B cells,but not on T cells".Immunol.Today.15(1):19–26.doi:10.1016/0167-5699(94)90021-3.PMID 7907877.
[3] Minty A,Chalon P,Derocq JM,Dumont X,Guillemot JC,Kaghad M,Labit C,Leplatois P,Liauzun P,Miloux B(March 1993)."Interleukin-13 is a new human lymphokine regulating inflammatory and immune responses".Nature.362(6417):248–50.doi:10.1038/362248a0.PMID 8096327.
[4] Tu M,Wange W,Cai L,Zhu P,Gao Z,Zheng W(2016)."IL-13 receptorα2 stimulates human glioma cell growth and metastasis through the Src/PI3K/Akt/mTOR signaling pathway".Tumour Biology:The Journal of the International Society for Oncodevelopmental Biology and Medicine.37(11):14701–14709.doi:10.1007/s13277-016-5346-x.PMID 27623944.
[5] eyfizadeh N,Seyfizadeh N,Babaloo Z(2014)."Interleukin-13 as an Important Mediator:A Review on its Roles in Some Human Diseases".Iranian Journal of Allergy,Asthma and Immunology.In Press.
[6] Ingram JL,Kraft M(2012)."IL-13 in asthma and allergic disease:asthma phenotypes and targeted therapies".The Journal of Allergy and Clinical Immunology.130(4):829–42,quiz 843–4.doi:10.1016/j.jaci.2012.06.034.PMID 22951057.
[7] 支气管哮喘患儿血清中Eotaxin、IL-13的表达水平及临床意义[J].魏淑丽,黄雪玲.川北医学院学报.2018(02)
欢迎您浏览更多关于重组大鼠IL-13的相关新闻资讯信息
