乙酸钴在有机合成中的用途
发布日期:2020/12/1 16:50:49
乙酸钴为深红色单斜棱形结晶,140 °C失水生成无水物。易溶于水,亦溶于稀酸、异丁醇、戊醇、乙酸乙酯、吡啶和无水联氨。

制备
乙酸钴由金属钴或氧化钴为原料,与硝酸反应生成硝酸钴溶液。然后,再与碳酸氢铵(或纯碱)溶液反应,生成碳酸钴沉淀。最后,将沉淀洗涤和分离,经乙酸酸化即可得到醋酸钴。
用途
在有机合成中,乙酸钴很少单独使用。当它与其它试剂搭配使用 [例如:O2、Mn(OAc)2、N-hydroxyphthalimide (NHPI)]时,可以应用于多种官能团的氧化以及C-C、C-S和C-P键的形成反应。
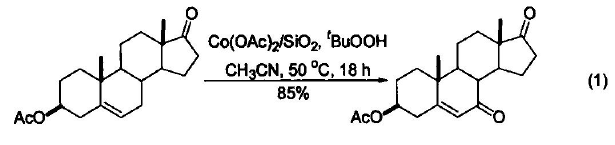
在二氧化硅负载的醋酸钴的催化下,叔丁基过氧化氢能高效地把类固醇的烯丙基碳氢键氧化成为羰基,得到α,β-不饱和化合物(式 1 )[1]。这种方法中的催化剂可以回收重复使用,与CrO3、氯铬酸吡啶盐酸盐( PCC )及重铬酸吡啶盐( PDC )等传统氧化试剂相比较,具有反应更易处理和对环境危害小的优点。
在室温下,Co(OAc)/O2/NHPI体系可以把多取代吡唑啉氧化生成相应的吡唑。这类化合物具有多种生物活性(式2)[2]。
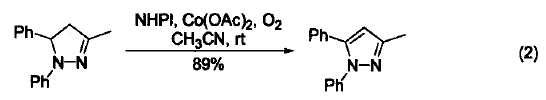
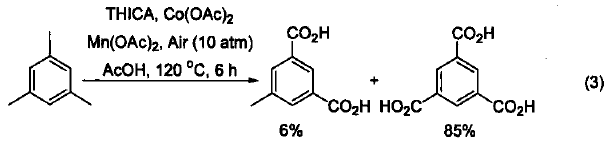
在Co(OAc)2和Mn(OAc)2存在下,利用三羟基异氰尿酸(THICA)在空气中可以使均三甲苯发生氧化。通过改变Co(II)/Mn(II)的比例以及空气的压力,可以高产率和高选择性地得到用于合成聚酯材料的均三苯甲酸(式3)[3]。
在比较温和的条件下,用离子液体[bmim][PF6]作溶剂,Co(OAc)2/O2/NHPI体系可以选择性地氧化二羟基化合物中的仲羟基(式4)[4]。
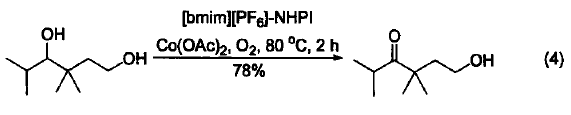
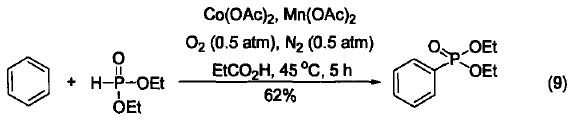
在Co(OAc)2和NHPI的催化下,氧气能活化1,3-二噁烷的C-H键。在丙烯酸甲酯的存在下,该反应可以构筑新的C-C键得到合成内酯
的中间体(式5)[5]。在相似条件下,2-甲基-1,3-二噁烷与丙烯腈也能发生此类反应(式6)[6]。
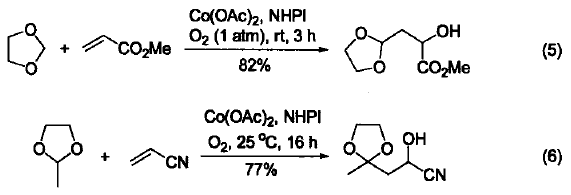
在Co(OAc)2/Mn(OAc)2复合体系的催化下,氧气能使含活泼亚甲基的化合物产生自由基,然后与烯烃发生加成反应。在此条件下,1,3-丙二酸二甲酯与1,5-环辛二烯首先进行自由基加成,然后再发生分子内的自由基成环反应,最后脱氢可生成二环化合物(式7)[7]。
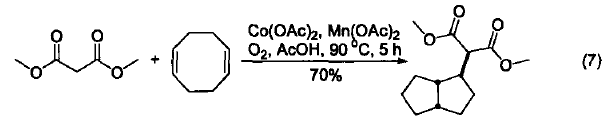
在手性配体诱导下,Co(OAc)2可以把硫酚加成到α,β-不饱和酮上形成新的C-S键(式8)[8]。
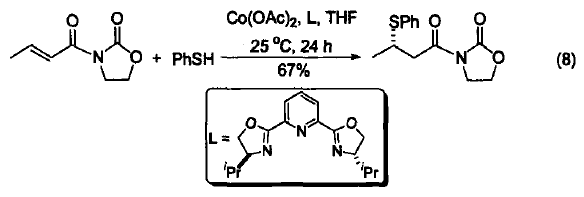
Mn(OAc)2/Co(OAc)2/O2复合体系能够引发亚磷酸二乙酯产生磷自由基。该自由基直接加成到苯环的双键后,再脱去一个氢原子就得到苯基取代的亚磷酸二乙酯。此类化合物是合成杀虫剂和生物活性分子的重要中间体,用传统方法很难制备,Co(OAc)2参与的催化反应突破了这一难题(式9)[9]。
参考文献
1. Salvador, J. A. R.; Clark, J. H. Chem. Commun. 2001,33.
2. Han, B.; Liu, Z.; Liu, Q.; Yang, L.; Liu, Z.; Yu, W. Tetrahedron 2006,62,2492.
3. Hirai, N.; Tatsukawa, Y.;Kameda, M,; Sakaguchi, S.; Ishii, Y. Tetrahedron 2006,62,6695.
4. Koguchi, S.; Kitazume, T. Tetrahedron Lett. 2006,47,2797.
5. Kagayama, T.; Sakaguchi, S.; Ishii, Y. Tetrahedron Lett. 2005,46,3687.
6. Hirano, K.; Iwahama, T.; Sakaguchi, S.; Ishii, Y. Chem. Commun. 2000,2457.
7. Hirase,K.; Iwahama, T.; Sakaguchi, S.;-lshii, Y. J. Org. Chem. 2002,67,970.
8. Kawatsura, M.; Komatsu, Y.; Yamamoto, M.; Hayase, S.; Itoh, T. Tetrahedron 2008, 64,3488.
9. Kagayama, T.; Nakano, A.; Sakaguchi, S.; Ishii, Y. Org. Lett 2006,8,407.
欢迎您浏览更多关于乙酸钴的相关新闻资讯信息



