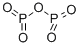-
外観
白色の粉末
-
種類
P2O5という組成式で表されますが、実際にはP4O10という分子で存在しています。そのため、十酸化四リンの名称が一般的です。
結晶構造は多形であり、3種類の結晶構造やガラス状、無定形状など様々な形を取ります。もっとも観察されるのは、P4O10分子からなる六方晶系です。密閉容器内で六方晶系を400 ℃以上に加熱すると、2種類の斜方晶系 (直方晶系) に変化します。
-
定義
本品は、次の化学式で表される無機酸化物である。
P2O5
-
性質
化学式はP2O5で表され、分子量は141.94です。CAS番号は1314-56-3で登録されています。融点は340°C、昇華点は360°Cで、常温常圧で固体です。
密度は2.39g/mlで、強い潮解 (脱水) 性と腐食性、刺激性、昇華性を持ちます。水とは反応するため可溶で、には溶けません。水との反応性が高く、空気中でも容易に水分を吸収します。五酸化リンは水と反応すると、メタリン酸やオルトリン酸などのポリリン酸を形成します。
-
溶解性
水に易溶。水と激しく反応して溶け、その溶液は酸性である。
-
解説
五酸化二リン.五酸化リン,十酸化四リンともいう.黄リンを十分な空気または酸素中で加熱すると得られる.揮発性の無色の結晶で,昇華するが,気相での分子量はP4O10分子に相当する.H,O,O′形の3変態が知られている.低温で安定なのはP4O10の分子結晶(H形)である.H形を密閉容器中で400 ℃ 以上に加熱すると,O形(三次元連続網目状構造)とO′形(二次元連続網目状構造)になる.いずれの変態もPO4のP=O以外の3個のO原子が隣接するP原子に共有された構造をしている.水には発熱的に溶け,四メタ(環状)リン酸を経てオルトリン酸になる.吸湿脱水性が強い.乾燥剤や有機合成の縮合剤,リン酸化剤,ガラスの製造,農薬,医薬品合成などに用いられる.粘膜を刺激し,眼に入ると危険である.
-
用途
ガス乾燥剤、脱水剤、有機合成
-
製造法
工業的には、黄リンを乾燥した燃焼室で酸化させることで合成できます。また、リン鉱石 (3Ca3 (PO4)2・CaF2) をコークスと (SiO2) 、鉄くずと混合させ、650 ℃の熱風で燃焼させることでも合成可能です。昇華によって精製できます。
-
用途
脱水剤、難燃剤用リン酸エステルの合成原料、消火剤
-
化学的特性
Phosphorus pentoxide is a white crystalline solid.
-
物理的性質
White, deliquescent, powdery solid; exhibits polymorphism; converts to several different crystalline forms on heating; the commercial material consists of hexagonal crystals; the hexagonal crystals on very rapid heating first melt at 420°C and then resolidify immediately to glassy orthorhombic crystals; slow heating of hexagonal crystals causes melting at 340°C which, on solidification, gives the same metastable orthorhombic form; the glassy material melts at about 580°C to a colorless and heavily viscous liquid; sublimes at 360°C; density of the commercial product 2.39g/cm3; reacts with water.
-
使用
Phosphorus(V) oxide is used as a drying and dehydrating agent, a condensation reagent in organic synthesis and a laboratory reagent. It is also used in sugar refining and in fire extinguishing. Phosphorus pentoxide in DMSO forms an Onodera reagent which oxidizes alcohols. It is capable of converting mineral acids to anhydrides.
-
製造方法
Phosphorus pentoxide is prepared by burning phosphorus in a plentiful supply of dry air or oxygen: P4 + 5O2 → P4O10 The crude product may contain a small amount of sesquioxide, P2O3, which may be removed by sublimation in ozonized oxygen.
-
調製方法
Phosphorus pentoxide or phosphoric anhydride (P2O5) is
formed by burning yellow phosphorus in dry air or oxygen.
-
一般的な説明
A white amorphous powder. Corrosive to metals and tissue and moderately toxic.
-
空気と水の反応
Readily absorbs moisture from the air forming a syrup of meta-, pyro-, and orthophosphoric acids. Reacts violently with water releasing considerable heat [Oldbury Chemicals, p. 9].
-
反応プロフィール
Phosphorus pentoxide reacts violently and exothermically with water. The heat can ignite surrounding or admixed combustible materials. Undergoes hazardous or violent reactions with metal hydroxides and oxides, formic acid, hydrogen fluoride and hydrofluoric acid, iodides, metals (in particular potassium and sodium), oxidizing agents (bromine pentafluoride, chlorine trifluoride, perchloric acid, oxygen difluoride, hydrogen peroxide), ammonia, and proparygl alcohol. [Bretherick, 5th ed., 1995, p. 1781; EPA, 1998]. A violent explosion occurs if a solution of perchloric acid in chloroform is poured over phosphorus pentaoxide [EPA, 1998].
-
危険性
Phosphorus pentoxide is a strong irritant. It is corrosive to skin and contact with eyes can be injurious.
-
健康ハザード
Because of its dehydrating action, phosphorus pentoxide is a highly corrosive substance. It is an irritant to the eyes, skin, and mucous membranes.Inhalation of its vapors caused chronic pulmonary edema, injury to lungs, and hemorrhage in test animals. The LC50 values varied significantly with the species.
LC50 value, inhalation (rats): 127 mg/m3/h .
-
火災危険
Reacts violently with water to evolve heat. Flammable poisonous gases may accumulate in tanks and hopper cars. Phosphorus pentoxide reacts violently with the following: ammonia, hydrofluoric acid, oxygen difluoride, potassium, sodium, propargyl alcohol, calcium oxide, sodium hydroxide and chlorine trifluoride. A violent explosion occurs if a solution of perchloric acid in chloroform is poured over phosphorus pentoxide. Avoid formic acid, hydrogen fluoride, inorganic bases, metals, oxidants, water. Readily absorbs moisture from air to form meta-, pryo-, or orthophosphoric acid.
-
法規情報
五酸化リンは、以下の国内法令に指定されています。
- 危険物船舶運送及び貯蔵規則
腐食性物質 (危規則第3条危険物告示別表第1)
- 船舶安全法
腐食性物質 (危規則第3条危険物告示別表第1)
- 航空法
腐食性物質 (施行規則第194条危険物告示別表第1)
- 港則法
危険物・腐食性物質 (法第21条2、則第12条、昭和54告示547別表二ロ)
-
取り扱い及び保管上の注意
取り扱い時の対策
混触危険物質は、水や金属類、可燃物、塩基、過塩素酸、還元性物質、強酸化剤です。取り扱い時や保管時に、近くに置かないでください。特に水とは激しく反応するため、注意して取り扱います。
取り扱い時は、保護衣と保護手袋、保護メガネを着用し、ドラフトチャンバー内で使用してください。
火災の場合
燃焼すると、りん酸化物など腐食性及び毒性のガスを生成することがあります。消火砂または二酸化炭素 (CO2)を用いて消火してください。棒状注水は行わないでください。さい。
保管する場合
遮光性のポリプロピレンまたはポリエチレン製の容器に入れて密閉します。直射日光を避け、涼しく換気のよい場所に施錠して保管してください。
参考文献
-
使用用途
1. 乾燥剤
五酸化リンは強い脱水性を持つため、乾燥剤として用いられています。金属性の乾燥剤と異なり、五酸化リンは水との反応が比較的穏やかです。穏やかな反応性から、安全性が求められるなどの乾燥剤として使用されます。
2. 縮合反応試薬
有機合成では、五酸化リンの強い脱水性を活かし、縮合剤として用いられます。カルボン酸に五酸化リンを作用させると、酸無水物を合成することが可能です。また、一級アミドに作用させると、ニトリルを生成します。
3. 酸化反応試薬
スワーン酸化 (英: Swern Oxidation) とは、アルコールからカルボン酸を得る酸化反応です。通常、とジメチルスルホキシドを試薬として用いますが、塩化オキサリルの代わりに五酸化リンを使用することもできます。
-
农业用途
Phosphoric anhydride is another name for phosphorus
pentoxide (P2O5). Anhydrides react with water to give
acids. For example, sulphur trioxide reacts with water to
give sulphuric acid, or acetic anhydride reacts with water
to give acetic acid. Similarly, phosphorus pentoxide has
great affinity for water and dissolves in it to give
phosphoric acid, and therefore, is known as phosphoric
anhydride.
-
安全性プロファイル
Poison by inhalation. A
corrosive irritant to the eyes, shin, and
mucous membranes. With the appropriate
conditions it undergoes hazardous reactions
with formic acid, hydrogen fluoride,
inorganic bases, iodides, metals, methyl
hydroperoxide, oxidants (e.g., bromine,
pentafluoride, chlorine trifluoride, perchloric
acid, oxygen Difluoride, hydrogen peroxide),
3-propynol, water. When heated to
decomposition it emits toxic fumes of POx.
-
職業ばく露
This material is used as an intermediate in organic synthesis, catalyst, condensing agent; dehydrating agent; in the preparation of acrylate esters, surfactants, sugar refining; medicine, fire extinguishing; and special glasses.
-
純化方法
It has been sublimed at 250o under vacuum into glass ampoules. It fumes in moist air and reacts violently with water. It is an excellent drying agent for use in desiccators. HARMFUL VAPOURS and attacks skin. [Manley J Chem Soc 121 331 1922, Klements in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 541 1963.]
-
不和合性
Reacts violently and exothermically with water, forming ignition level heat and highly corrosive phosphoric acid. Keep away from the combination of moisture and combustible materials. Phosphorus pentoxide reacts violently with the following: perchloric acid; ammonia, hydrofluoric acid; oxidizers, hydrogen fluoride; formic acid, oxygen difluoride, potassium, sodium, propargyl alcohol; calcium oxide; inorganic bases; sodium hydroxide and chlorine trifluoride. Attacks many metals in presence of water. Incompatible with oxidizers (chlorates, nitrates, peroxides, permanganates, perchlorates, chlorine, bromine, fluorine, etc.); contact may cause fires or explosions. Keep away from alkaline materials, strong bases, strong acids, oxoacids, epoxides, alcohols, ammonia. Undergoes hazardous or violent reactions with metal hydroxides and oxides, formic acid, hydrogen fluoride and hydrofluoric acid, iodides, metals (in particular potassium and sodium), ammonia, and proparygl alcohol.
-
廃棄物の処理
Decompose with water, forming phosphoric and hydrochloric acids. The acids may then be neutralized and diluted slowly to solution of soda ash and slaked lime with stirring then flush to sewer with large volumes of water.
-
参考文献
H. Arnold, M.T. Averbuch-Pouchot, J.C. Guitel, Z. Krist., 177, 139 (1986).