-
外観
白色~うすい黄色, 結晶~結晶性粉末又は塊
-
性質
五塩化リンの外観は、白色または淡黄色の結晶あるいは固塊です。強い刺激臭および発煙性を持ち、極めて高い吸湿性を有します。五塩化リンは、通常と塩素ガスを反応させて製造されます。
この反応はエンタルピー的に有利な反応なので進みやすく、非常に多量の五塩化リンがこの方法で製造されています。しかし、180℃においては五塩化リンは三塩化リンと塩素との間で平衡状態となるので、五塩化リンには塩素が含まれて緑色を呈していることがあります。
五塩化リンは、非常に反応性の強い物質です。水と反応すると塩化水素を発生します。さらに、加水分解が進行すると、塩化水素に加えてリン酸も生成します。そのため、水に溶けることはできませんが、二硫化炭素やベンゼンなどの有機溶媒には可溶です。
-
溶解性
水と反応, エタノールに可溶。水を加えると発熱して、りん酸と塩酸とに分解する。また、エタノールを加えると発熱して分解し、塩化エチルを生成する。
-
解説
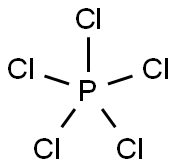
化学式PCl5。三塩化リンPCl3と,塩素を直接反応させると得られる。淡黄色の正方晶。融点167℃(919mmHg),昇華温度160℃,比重2.119(20℃)。二硫化炭素,四塩化炭素,塩化ベンゾイルに可溶。五塩化リンは,結晶状態では四面体形の[PCl4]+と八面体形の[PCl6]-のイオン性構造。気体では三方両錐形分子。四塩化炭素中では二つの八面体の稜を共有した二量体として存在する。気体にすると,100℃で数%,300℃以上では完全に三塩化リンと塩素に解離する。
株式会社平凡社 世界大百科事典 第2版について 情報
-
用途
医薬(抗生物質、ビタミンB1、塩酸プロカイン、ペカミン、アクリノール、シンナピリン、ビザチン)各種塩化物の製造、ドーピングガス
-
危険性
五塩化リンは、GHS分類において、急性毒性 (経口) 、皮膚腐食性・刺激性、眼に対する重篤な損傷・眼刺激性、特定標的臓器・全身毒性 (単回および反復ばく露) が認められています。さらに、水などの物質と激しく反応することから爆発の危険性もあり、取り扱いには注意が必要です。使用する際には、保護メガネとゴム手袋の着用は必須です。
-
使用上の注意
吸湿性が極めて強い
-
化学的特性
Phosphorus pentachloride is a pale yellow, fuming solid with an odor like hydrochloric acid.162℃ sublimation and partial decomposition. All decomposed into chlorine gas and phosphorus trichloride at 300℃. Soluble in carbon disulfide, carbon tetrachloride. Decomposed in water, hydrolyzed in moist air into phosphoric acid and hydrogen chloride, white smoke and special irritating odor occur, strongly irritate the eyes.
-
使用
Phosphorus pentachloride is used as a chlorinating agent to convert acids into acid chlorides, as a dehydrating agent, and as a catalyst.
-
定義
ChEBI: Phosphorus pentachloride is a phosphorus halide.
-
一般的な説明
Phosphorus pentachloride is a greenish-yellow crystalline solid with an irritating odor. Phosphorus pentachloride is decomposed by water to form hydrochloric and phosphoric acid and heat. This heat may be sufficient to ignite surrounding combustible material. Phosphorus pentachloride is corrosive to metals and tissue. Long term exposure to low concentrations or short term exposure to high concentrations can result in adverse health effects from inhalation.
-
反応プロフィール
Phosphorus pentachloride is a lightly yellow, fuming crystalline material, highly caustic, corrosive and toxic. Flammable by chemical reaction. Violent exothermic reaction with water or steam. When heated to decomposition Phosphorus pentachloride emits highly toxic fumes of chlorides and oxides of phosphorus. Explosive reaction with alkaline metals (sodium, potassium), urea. Ignites on contact with fluorine. Violent reaction with aluminum, chlorine trioxide, hydroxylamine, magnesium oxide, nitrobenzene, phosphorus(III) oxide, potassium. Carbamates form explosive products [Bretherick, 5th ed., 1995, p. 1360]. Reaction with the mixture of chlorine and chlorine dioxide causes explosion [Mellor, 1941, vol. 2, p. 281; 1940, vol. 8, p. 1013].
-
使用用途
五塩化リンの工業的な使用用途として、医薬品 (抗生物質、ビタミン、その他) 染料等の各種塩化物の製造における試薬が挙げられます。五塩化リンは、その強い反応性からさまざまな有機化合物、無機化合物の塩素化試薬として有機合成に広く用いられます。
1. 有機化合物の合成
有機化合物との反応例として、カルボン酸と反応してカルボン酸塩化物を生成し、アルコールと反応して塩化アルキルを生成します。この反応は塩素化反応としては非常に優れていますが、副生成物であるリン酸トリクロリドが固体で取り除きにくいということが欠点です。そのため、研究室レベルの実験では、気体である二硫化酸素を副生成物とする塩化チオニルなどの試薬の方がより多く使われます。
さらに、第3級アミドと反応させて、ビルスマイヤー試薬を生成する際にも使用されます。この試薬は、アミドと活性芳香族化合物から芳香族ケトンやアルデヒドの合成に利用することが可能で、非常に有用です。
それ以外にも、アリール位やベンジル位の炭素に結合する水素を塩素に置換するといった反応にも使用されています。
2. 無機化合物の合成
五塩化リンは反応性が非常に高く、二酸化窒素などの無機物を塩素化することができます。また、様々な金属元素を塩素化し、金属の塩化物と付加体を作るという性質を持っています。しかし、有機物の場合と同様に、現在では他の反応剤を使用することが多くなりました。
無機化合物とのその他の反応例として、と反応し、の電解質に用いられるヘキサフルオロリン酸リチウムを生成するといった反応もあります。
-
安全性プロファイル
Poison by inhalation.
Moderately toxic by ingestion. A severe eye,
skin, and mucous membrane irritant.
Corrosive to body tissues. Flammable by
chemical reaction. Explosive reaction with
chlorine dioxide + chlorine, sodium, urea +
heat. Reacts to form explosive products with
carbamates, 3'-methy-2-nitrobenzanilide
(product explodes on contact with air).
Ignites on contact with fluorine. Reacts
violently with moisture, ClO3, hydroxyl-
amine, magnesium oxide, nitrobenzene,
phosphorus(Ⅲ) oxide, K. To fight fire, use
CO2, dry chemical. Incompatible with
aluminum, chlorine dioxide, chlorine,diphosphorus trioxide, fluorine,
hydroxylamine, magnesium oxide, 3'-methyl-
2-nitrobenzanilide, nitrobenzene, sodium,
urea, water. Will react with water or steam to
produce heat and toxic and corrosive fumes.
Used as a catalyst, chlorinating and
dehydrating agent. When heated to
decomposition it emits highly toxic fumes of
Cland POx.
-
職業ばく露
Phosphorus pentachloride is used as a as a chlorinating and dehydrating agent and as a catalyst. It is used in the manufacture of agricultural chemicals;chlorinated compounds; gasoline additives, plasticizers and surfactants; and in pharmaceutical manufacture
-
概要
五塩化リン (英: phosphorus pentachloride) とは、化学式PCl5であらわされる無機化合物であり、リンの塩化物です。
モル質量は208.2g/mol、昇華点は160℃、比重は2.1、CAS番号は10026-13-8です。同じくリンの塩化物である三塩化リンや塩化ホスホリルと同様に、さまざまな物質の合成に非常に良く用いられてます。
気体中での五塩化リンは三方両錐型の構造をしており、塩化物イオンが1つ脱離したカチオンは正四面体構造を、1つ付加したアニオンは正八面体構造を取ります。
-
輸送方法
UN1806 Phosphorus pentachloride, Hazard class: 8; Labels: 8-Corrosive material.
-
純化方法
[All operations should be carried out in an efficient fume cupboard.] Sublime it at 160-170o in an atmosphere of chlorine. Excess chlorine is then displaced by dry N2 gas. All subsequent manipulations should be performed in a dry-box [Downs & Johnson J Am Chem Soc 77 2098 1955]. It fumes in moist air and attacks the eyes and the mucous membranes of the nose. It should not be breathed in and has very HARMFUL VAPOURS (wash burning eyes with aqueous NaHCO3).
-
不和合性
Phosphorus pentachloride is a powerful oxidizer. Reacts with water (violent), magnesium oxide, chemically active metals, such as sodium and potassium, alkalis, amines, carbamates, aluminum powder, combustibles, fluorine, phosphorus pentoxide, phosphorus trioxide, and many other substances. Hydrolyzes in water (even in humid air) to form hydrochloric acid and phosphoric acid. Corrosive to many metals, forming flammable and explosive hydrogen gas. Attacks plastic and rubber.
-
廃棄物の処理
Decompose with water, forming phosphoric and hydrochloric acids. Neutralize acids and dilute if necessary for discharge into the sewer system.