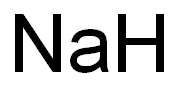-
外観
白色~灰色~暗い青色粉末~結晶
-
性質
化学式NaH。灰色の結晶性粉末。立方晶系岩塩型構造。典型的な食塩型水素化物で,Na+とH-(水素化物イオン)から成るイオン格子を形成している。比重0.93。屈折率1.470。生成熱12.8kcal/mol。高温でナトリウムと水素とに分解する。水素の解離圧は425℃で1気圧。乾燥空気中では安定。湿った空気によって分解し,水と激しく反応して水素を発生し,水酸化ナトリウムを生ずる。ベンゼン,二硫化炭素,四塩化炭素,液体アンモニアに不溶。
-
溶解性
水素化ナトリウムは,水で分解して, 水素を発生する。ベンゼン, 二硫化炭素, 四塩化炭素, 液体アンモニアには溶解しない。水と激しく反応して、水酸化ナトリウムと水素を生ずる。
-
解説
NaH(24.00).水素化ナトリウムは,油に分散するか,触媒のアントラセンとまぜた金属ナトリウムに,250 ℃ で H2 を通すと得られる.立方晶系のイオン結晶.塩化ナトリウム型構造で,Na-H2.44 Å.密度0.92 g cm-3.425 ℃ で分解する.CCl4,ベンゼンに不溶.水とはげしく反応し,H2 を発生してNaOHになる.室温で乾いた空気中では安定であるが,湿った空気中では発火する.還元性が強く,金属の酸化物や塩化物を金属に還元し,有機物も還元する.水素化ホウ素ナトリウムの製造原料,有機合成反応で還元,水素添加,縮合,触媒などに用いられる.そのほか,脱水,乾燥剤,金属表面の酸化物のさび落としなどにも用いられる.森北出版「化学辞典(第2版)
-
用途
還元剤、有機化合物の合成
-
用途
金属塩化物の還元剤, 有機合成における還元剤, 水素添加剤, 縮合剤, 脱水剤, 水素発生剤など。NaBH4の合成にも使用されている。
-
構造
水素化ナトリウムは、LiH、KH、RbH、およびCsHと同様に、立方晶のNaCl結晶構造をとっています。この構造では、各Na+イオンは八面体形状の6つのH−中心に囲まれています。H−のイオン半径は146pmで、F−のイオン半径 (133pm) とほぼ同等です。
Na-とH+で形成されたものは「インバース水素化ナトリウム」と呼ばれます。この化合物は、通常とは異なり水素からへ電子が移動するため、非常に高いエネルギーをもっています。インバース水素化ナトリウムの生成にはアダマンザンが用いられ、この分子はH+を不可逆的に封入し、Na-との相互作用からH+を保護します。
-
製法
水素化ナトリウムは油に分散するか、触媒のと金属ナトリウムを混合し、250℃の温度下で水素を通すことによって得られます。水素化ナトリウムは、安全に取り扱うために、鉱油中60%の分散形態で市販されています。
-
使用上の注意
湿った空気では分解するため、発火に注意。水とは爆発的に反応して水素を発生するため、取扱に注意する。不活性ガス封入
-
説明
Sodium hydride, is a binary salt that has a specific hazard of releasing hydrogen upon contact with water. It is an odorless powder that is violently water reactive. The four-digit UN identification number is 1427. The NFPA 704 designation is health 3, flammability 3, and reactivity 2. The white space at the bottom of the diamond has a W with a slash through it, indicating water reactivity.
-
化学的特性
Grey solid. Pure sodium hydride forms colorless cubic crystals; however, the commercial product contains traces of sodium metal, giving it a light gray color. At atmospheric pressure, sodium hydride slowly evolves hydrogen above 300 ℃. At 420 ℃ decomposition is rapid but melting does not take place. Sodium hydride is a salt and therefore insoluble in inert organic solvents. It dissolves in molten sodium hydroxide, in sodium – potassium alloys and in molten LiCl – KCl eutectic mixtures (352 ℃). Sodium hydride is stable in dry air but ignites above 230 ℃, burning to form sodium oxide. It is hydrolyzed rapidly in moist air and as a dry powder it is spontaneously flammable. Sodium hydride reacts extremely violently with water, the heat of hydrolysis being sufficient to ignite the liberated hydrogen. It reacts with carbon dioxide to form sodium formate.
-
物理的性質
Silvery needles; refractive index 1.470; density 0.92 g/cm3; decomposes at 800°C; decomposes explosively in water; reacts violently with lower alcohols; dissolves in molten sodium and molten sodium hydroxide; insoluble in liquid ammonia, benzene, carbon tetrachloride and carbon disulfide. Sodium hydride is available commercially
as 80 % and 60 % dispersions in mineral oil.
The light-gray pourable material has an average particle size of 10 mm (Degussa, Chemetall, Ventron). The oil protects the surface of
the highly reactive sodium hydride, which easily becomes passivated by the slightest atmospheric exposure or, worse, can ignite on longer
contact with air.
-
使用
Sodium hydride is used to enhance the condensation reactions of carbonyl compounds through the Dieckmann condensation, Stobbe condensation, Darzens condensation and Claisen condensation. It acts as a reducing agent used to prepare diborane from boron trifluoride. It is also used in fuel cell vehicles. Further, it is used to dry some organic solvents. In addition to this, it is involved in the preparation of sulfur ylides, which is utilized for the conversion of ketones into epoxides.
-
調製方法
Sodium hydride, reactive with water yielding hydrogen gas and NaOH solution, formed by reaction of sodium and hydrogen at about 360 °C (680 °F). Used as a powerful reducing agent.
-
定義
sodium hydride: A white crystallinesolid, NaH; cubic; r.d. 0.92; decomposesabove 300°C (slow);completely decomposed at 800°C.Sodium hydride is prepared by thereaction of pure dry hydrogen withsodium at 350°C. Electrolysis ofsodium hydride in molten LiCl/KClleads to the evolution of hydrogen;this is taken as evidence for the ionicnature of NaH and the presence ofthe hydride ion (H–). It reacts violentlywith water to give sodium hydroxideand hydrogen, with halogensto give the halide and appropriatehydrogen halide, and ignites spontaneouslywith oxygen at 230°C. It is apowerful reducing agent with severallaboratory applications.
-
一般的な説明
A silvery to whitish powder or slurry in oil. Used to make other chemicals.
-
空気と水の反応
Highly flammable. Ignites or explodes in contact with air of high humidity [Bretherick 1979 p. 107]. Reacts violently with water producing a caustic solution (NaOH) and hydrogen (H2). Heat of reaction may ignite the hydrogen.
-
反応プロフィール
Sodium hydride is a powerful reducing agent. Attacks SiO2 in glass. Ignites on contact with gaseous F2, Cl2, Br2, and I2 (the last at temperatures exceeding 100°C), especially in the presence of moisture, to form HF, HCl, HBr, and HI [Mellor 2:483 1946-47]. Reacts with sulfur to give Na2S and H2S [Bretherick 1979 p. 107]. Can react explosively with dimethyl sulfoxide [Chem. Eng. News 44(24):7 1966]. Reacts vigorously with acetylene, even at -60°C [Mellor 2:483 1946-47]. Spontaneously flammable in fluorine. Reaction with dimethylformamide, when heated, runs away [Chem. Eng. News, 1982, 60(28), 5]. Initiates a polymerization reaction in ethyl-2,2,3-trifluoropropionate such that the ester decomposed violently [Bretherick 5th ed. 1995]. Presence in the reaction of diethyl succinate and ethyl trifluoroacetate, has twice caused explosions [Chem. Brit., 1983, 19, 645].
-
危険性
Dangerous fire risk, reacts violently with
water evolving hydrogen. Irritant.
-
健康ハザード
SOLID: Will burn skin and eyes. Harmful if swallowed.
-
火災危険
FLAMMABLE. MAY EXPLODE ON CONTACT WITH WATER. Accidental contact with water used to extinguish surrounding fire will result in the release of hydrogen gas and possible explosion.
-
化学性质
強い還元性,水と激しく反応し,着火のおそれがある
-
法規情報
毒物及び劇物取締法では特に指定はありません。消防法において「第3類自然発火性物質及び禁水性物質」「金属の水素化物」に該当しており、取り扱いには注意が必要です。
-
使用用途
1. 塩基
有機化学においては有用な塩基として用いられます。弱いブレンステッド酸の範囲の物質も脱プロトン化して、対応するナトリウム誘導体を与えることができます。ディークマン縮合、シュトッベ縮合、ダルツェン縮合、クライゼン縮合を介して、カルボニル化合物の縮合反応を促進するためにも広く使用されています。
2. 還元剤
水素化ナトリウムは特定の主要族化合物を還元します。に対しては、反応してジボランとを与え、ジシランおよびジスルフィド中のSi-SiおよびS-S結合も還元出来ます。ニトリルの水素化脱シアン化、イミンのアミンへの還元、アミドのアルデヒドへの還元を含む一連の還元反応は、水素化ナトリウムとヨウ化アルカリ金属からなる複合試薬によって行うことができます。
3. 水素貯蔵
水素化ナトリウムは車で使用する水素を貯蔵するために、使用が提案・検討されています。水素化ナトリウムを含むプラスチックペレットを、水の存在下で粉砕し、水素を放出する実験も行われています。この技術の課題の1つは、水酸化ナトリウムから水素化ナトリウムの再生です。
4. その他
糖工学用試薬・糖分析用試薬・メチル化試薬など、各種の試薬としても利用されています。その他の用途としては、「脱水」「乾燥剤」「金属表面の酸化物のさび落とし」などが挙げられます。
-
処理と保存
取扱い及び保管上の注意は、下記の通りです。
- 容器を密栓し、乾燥した冷暗所に保管する。
- 激しい反応と火災のおそれがあるので、水や湿気との接触を避けて保管する。
- 屋外や換気の良い区域のみで使用し、湿気を遮断した不活性ガス雰囲気下で取り扱う。
- 使用時は保護手袋、保護眼鏡を着用する。
- 取扱い後はよく手を洗浄する。
- 皮膚に付着した場合は、 固着していない粒子を皮膚から払いのけ、冷たい水に浸し、湿った包帯で覆う。
- 眼に入った場合は、水で数分間注意深く洗う。
参考文献
-
安全性プロファイル
The powder ignites spontaneously in air. Flammable when exposed to heat or flame. Potentially explosive reaction with water, diethyl succinate + ethyltrifluoroacetate (above 60℃), dimethyl sulfoxide + heat, sulfur dioxide. Ignition or violent reaction with dimethylformamide (above 50℃), ethyl 2,2,3-trifluoropropionate, oxygen (at 230℃). Incompatible with acetylene + moisture, glycerin, halogens, sulphur. Normal fire extinguishers are unsuitable, use sand, ashes, solurn chloride. The commercial material may contain traces of sodium. When heated to decomposition it emits toxic fumes of Na2O. See also HYDRIDES.
-
合成方法
水素と金属の直接反応でつくる