二氧化锆是一种高温耐腐蚀材料,它有三种晶型。低于1373K温度时为单斜晶型,于1373~2173K温度下为四方晶型,高于2173K温度时为立方晶型,其体积并伴随晶型转变而发生变化。为克服二氧化锆晶型不稳定的缺点,目前已研制出部分稳定氧化锆和稳定氧化锆,它们已成为重要的精细陶瓷材料。
二氧化锆有三种结晶变体,在约1100℃以下稳定的是单斜晶系的结晶形态。熔点2700℃,密度5.89克/厘米3。在自然界以斜锆石矿物存在。可由锆石制取,或从铜矿副产品及处理磷酸盐过程中回收得斜锆石。线膨胀系数和热导率都小,在氧化气氛或中等还原气氛中都很稳定。但受热时间过长时因晶体变形,体积略有变化。二氧化锆的主要用途是作耐火材料和特种合金。若在纯二氧化锆中加入氧化钙或氧化镁等耐高温氧化物,可使氧化锆的晶型稳定。这种晶型稳定的二氧化锆不但保持原有的优良性能,而且抗液态金属腐蚀能力很强,是有广泛用途的优质耐火材料,如用作炼钢铸罐和流槽的内衬,熔化金属用的坩埚等。二氧化锆用于制造陶瓷釉料,具有涂层光亮、色彩鲜艳、耐蚀性好等优点。用于制造颜料(适量加入)可以提高颜料的色彩质量,并使之不易褪色。二氧化锆很硬,用作研磨剂。据报道,1988 年工业用二氧化锆的比例为: 耐火材料占65%,陶瓷颜料15%,研磨剂15%。二氧化锆用作玻璃添加剂能提高玻璃的弹性、化学稳定性及耐热性。眼镜玻璃中加入5%的二氧化锆可防止红外线和紫外线的辐射。还用于制造一些具有特殊优良性能的材料,如不会因温度骤变而破裂的搪瓷,新型固体电解质燃料电池的陶瓷薄膜,二氧化锆纤维及制造齿列矫正托架的陶瓷等。
【理化性质】
二氧化锆简称氧化锆,化学式ZrO2。分子量123.22。无色单斜晶体或白色无定形粉末。相对密度 5.68(单斜晶体),熔点2715℃。沸点约5020℃。不溶于水、盐酸和稀硫酸,溶于氢氟酸、硝酸和热的浓硫酸。由灼烧二氧化锆水合物或挥发性含氧酸锆盐所得的二氧化锆为硬的白色粉末,不溶于水,稍加热而形成的氧化锆易溶于无机酸,强热灼烧过的氧化锆则仅溶于氢氟酸和浓硫酸,而熔融状态结晶出的二氧化锆只与氢氟酸作用。二氧化锆为两性氧化物,与碱共熔生成正锆酸盐与偏锆酸盐,锆酸盐易水解为ZrO2·xH2O白色沉淀。与金属氧化物共熔生成锆酸盐。化学性质稳定。具有特殊的抗酸碱侵蚀能力和优良的机械性能。由锆英石与碱共熔,用水浸出锆酸盐,与盐酸作用后再煅烧制得。用于高纯盐的制备、制陶瓷釉、x-射线照像、红外光谱仪中的光源、煤气灯罩、搪瓷、耐火材料、高纯分析试剂、电绝缘材料、特种玻璃、医药和压电晶体材料等。
用途:由于二氧化锆在灼烧时发射强烈白光,用作灯丝、红外光谱仪的光源及用于X射线照相工作,制颜料、研磨料、搪瓷、高温坩埚、高压高频陶瓷、特种玻璃,添有氧化镁的二氧化锆用于制高温玻璃,还制各种含锆合金以及作高纯试剂。医药上用于制治皮炎的油膏。
【制备方法】
以锆英石或其他锆化合物为原料生产二氧化锆的锆化合物制取方法。二氧化锆的工业生产方法有湿法和火法之分,湿法所得产品的纯度一般能达到99%左右,并能制得高纯产品,但生产流程较长。火法制得的产品纯度约为95%~98%。按生产产品的方法又分为二氧化锆制取和稳定氧化锆制取工艺。
二氧化锆制取工艺:湿法制取二氧化锆是在高温下煅烧氯氧化锆,使之分解成纯度为99.5%的二氧化锆。也可将氯氧化锆溶解于水中,用氨水沉淀,经洗涤、烘干和煅烧来制取。用经多次重结晶提纯的氯氧化锆为原料可以制得高纯二氧化锆。火法制取有电熔法和等离子体冶金法。电熔法是将锆英石和碳混合均匀,入电弧炉熔炼,硅以一氧化硅的气态形式除去,产出的氧化锆经破碎、整粒处理而获得粗二氧化锆。等离子体冶金法是使锆英石在等离子区高温热离解成二氧化锆和活性二氧化硅,然后用热碱液洗去离解产物中的二氧化硅,便得二氧化锆。
稳定氧化锆制取工艺:工业用耐火材料的稳定氧化锆,大多数用电熔法制取。在锆英石电熔过程中加入碳及稳定剂氧化钙,在除硅的同时,氧化锆和氧化钙作用生成固溶体,再经粉碎和整粒处理,即可制得稳定氧化锆。精细陶瓷所用的稳定和部分稳定氧化锆一般采用湿法制取。目前最成熟和常用的是中和沉淀法,其制取工艺见图。将提纯过的氯氧化锆用纯水溶解,过滤除去不溶物,调整溶液中的锆浓度,并加入需要量的氯化钇溶液(或其他稀土金属或碱土金属的氯化物溶液)后,加氨水中和沉淀。沉淀物用热水洗涤后,再经过滤、干燥和煅烧。煅烧产品经粉碎等处理便可获得超微细的稳定氧化锆粉末。
部分稳定氧化锆是控制加入稳定剂的量,使其不足以达到完全稳定而制得的。部分稳定氧化锆具有高强度和抗热震性能,在结构陶瓷中有着相当广泛的用途。
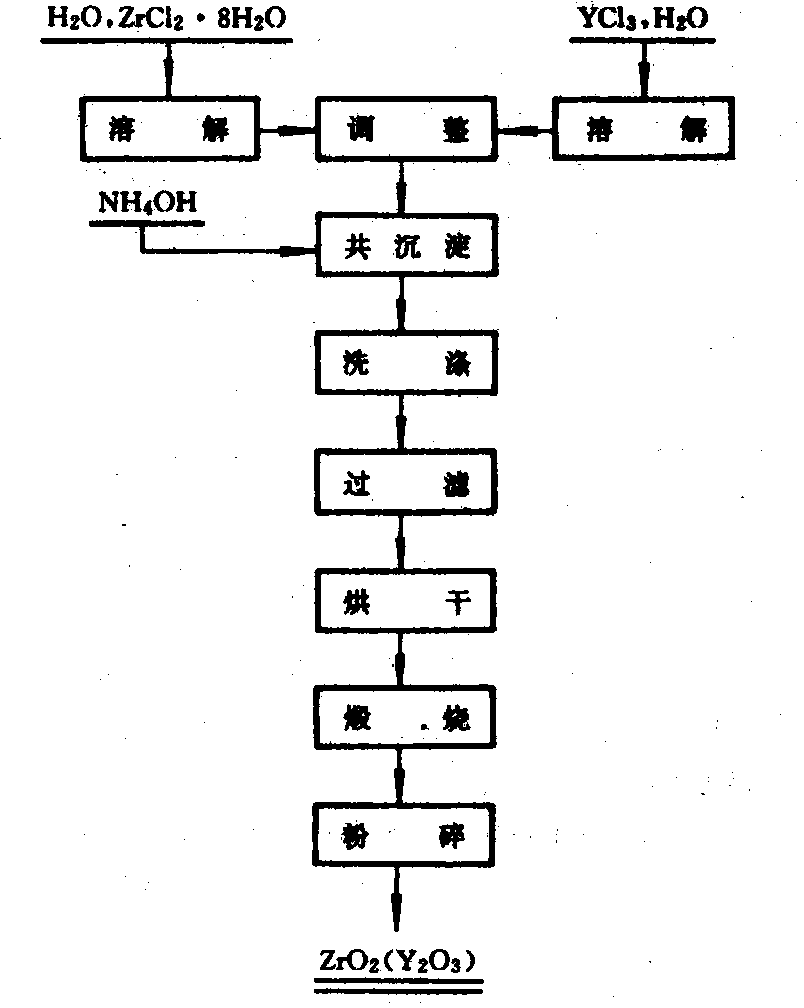
稳定氧化锆的制取工艺流程
【应用前景】
随着精细陶瓷工业的迅速发展,需要粒径小、纯度高、组成均匀的二氧化锆超微细粉来制造致密度大、收缩率小、有独特性能的器件。为此,人们已提出了一些生产二氧化锆超微细粉的新技术和新工艺,主要有加水分解法、水热合成法、有机锆化合物制备法等。这些新技术和新工艺有着良好的工业应用前景。
【二氧化锆氯化】
以碳作还原剂,用氯气氯化二氧化锆制取四氯化锆的锆氯化方法。将由碳化锆或锆英石氯化制得的含铪四氯化锆 (含HfCl40.5%~2.0%),经锆铪分离后即可制成无铪二氧化锆和无锆二氧化铪。它们再次氯化所制成的四氯化锆或四氯化铪主要用于生产原子能级海绵锆或海绵铪。有竖炉氯化和流态化氯化两种方法,所用的竖炉和流态化炉与锆英石氯化的相同。二氧化锆氯化的反应为:ZrO2+2C+2Cl2=ZrCl4+2CO
在773K时已达到较大的氯化反应速度,反应生成的是CO和CO2,在973K以上则以生成CO为主。
竖炉氯化 20世纪60年代,二氧化锆用固定床层的竖式炉氯化,氯化炉料由含ZrO281%、炭黑14.5%和作为粘结剂的纸浆废液4.5%混合后备团,再经过烘干、焦化而成。这种有一定强度的团块从炉顶的密封料仓加入,依靠石墨电极和物料层的电阻加热保持1073~1173K的氯化温度。竖炉氯化存在工序多、产率低的缺点。
流态化氯化 ZrO2和焦炭粉混合后用螺旋输送机加入炉内,为减少粉尘飞逸,炉料可经预先制粒。氯化产物进入三级串联的镍质冷凝器收集,各级温度分别控制在423~473K、373~423K、323K。SiCl4被冷冻到263K的TiCl4和SiCl4混合液浇淋捕集后送到精馏分离回收。ZrCl4中杂质含量(质量分数ω/%)为:Fe0.11,Al0.05,Ti0.05,Si0.03。
二氧化铪的性质与二氧化锆很相近,氯化机理和工艺亦相似。但HfO2氯化反应的吉布斯自由能变化比ZrO2更负,在相同温度时更易氯化。基于二氧化铪产量仅为二氧化锆的1%~2%,所以用竖炉氯化即可满足要求。
【二氧化锆钙还原】
用金属钙或氢化钙还原二氧化锆制取金属锆粉的金属锆生产方法。产品纯度可达98%以上,主要用作电子管吸气剂。此法为维特金(E.Wedekind)和里威士(S.J.Lewis)于1913年首先研究成功,现已用于工业生产。中国在70年代开始使用这种生产方法。
将二氧化锆、金属钙和氯化钙混合均匀后,迅速装到不锈钢反应罐内,密封后放到竖式反应炉中。将反应罐抽真空并反复用氩气冲洗后,保持氩气压力略高于常压,缓慢升温,在573K温度左右保温一段时间以除去炉料中的水分,然后再继续升温至1173~1223K进行还原反应。还原反应为可逆反应,反应式为:ZrO2+2Ca⇌Zr+2CaO
当钙过量时,反应向右进行;如降低反应罐中的压力,则由于钙的升华也会使反应向左进行。反应放出大量的热,会使罐中温度突然升高,导致坩埚熔化。在炉料中加入干燥的氯化钙可使反应速度变得较为均匀,并能减缓开始反应的速度。反应完毕后,将反应罐冷却至室温。卸炉后,将产物放入水中,溶解残留的金属钙,并反复用盐酸浸出和水洗,再经过过滤、干燥和筛分即得锆粉。在大批量生产时,为防止温度上升过高,可把炉料分装在几个坩埚内。在较低温度下亦可保证反应平稳进行。二氧化锆和金属钙的纯度直接影响产品的纯度,二氧化锆的大小则影响产品的粒度。由于经过大量水洗,产品含氧量较高而含氯量较低。
预先将钙与氢反应制成氢化钙,再与二氧化锆混合压型,在1273~1373K温度下还原,可制得含有一定氢量的更适合用作电子管吸气剂的锆粉。
金属钙在空气中易氧化,与水作用会燃烧和爆炸。锆粉是易燃、易爆物质,在生产、保存、运输和使用过程中都要采取适当防爆措施,以确保安全。
【用途与作用】
(1)二氧化锆导电陶瓷主要用于氧气传感器、高温电极材料(磁流体发电机装置中的电极)、火焰喷涂或等离子喷涂的高温无机涂层、高温发热材料等。
(2)二氧化锆用于制金属锆和锆化合物、制耐火砖和坩锅、高频陶瓷、研磨材料、陶瓷颜料和锆酸盐等主要用于压电陶瓷制品、日用陶瓷、耐火材料及贵重金属熔炼用的锆砖、锆管、坩埚等。也用于生产钢及有色金属、光学玻璃和二氧化锆纤维。还用于陶瓷颜料、静电涂料及烤漆。用于环氧树脂中可增加耐热盐水的腐蚀。
(3)氧化锆纤维是一种多晶质耐火纤维材料。由于ZrO2物质本身的高熔点、不氧化和其他高温优良特性,使得ZrO2纤维具有比氧化铝纤维、莫来石纤维、硅酸铝纤维等其他耐火纤维品种更高的使用温度。氧化锆纤维在1500℃以上超高温氧化气氛下长期使用,最高使用温度高达2200℃,甚至到2500℃仍可保持完整的纤维形状,并且高温化学性质稳定、耐腐蚀、抗氧化、抗热震、不挥发、无污染,是目前国际上最顶尖的一种耐火纤维材料。ZrO2的耐酸碱腐蚀能力大大强于SiO2和Al2O3。不溶于水,溶于硫酸及氢氟酸;微溶于盐酸和硝酸。能与碱共熔生成锆酸盐。
【氧化锆的稳定】
在氧化锆中加入适量添加剂可以抑制晶态的变化。为使假立方变态的氧化锆能在2000℃以内都稳定,从而防止由转化而引起制品的开裂,在氧化锆内要加入稳定剂。加入的稳定剂是与氧化锆晶系相同,离子半径相近的氧化物如CaO、MgO、 Y2O3、Nb2O3、CeO2、ScO3等。这些氧化物的离子半径 Ca2+ 0.106nm、Mg2+ 0.078nm、Y3+ 0.106nm、Ce4+ 0.102nm、Sc3+0.083nm与Zr4+的离子半径 (0.084nm) 相差不大,能与氧化锆形成固熔体使ZrO2稳定下来。
在氧化锆中加入其他氧化物或复合氧化物称为稳定剂或复合稳定剂。氧化锆的稳定方法:一种是电熔稳定、一种是烧结稳定。稳定处理前将氧化锆原料与稳定剂放入球磨机中进行混合细磨后方可进行稳定化处理。
氧化钙是氧化锆最常用的、价格便宜、稳定效果好的稳定剂。氧化钙的加入量,以重量计算3%~8%,以克分子计算10%~16%,即可得到ZrO-CaO的固熔体。ZrO2-CaO二元系相图如下图:
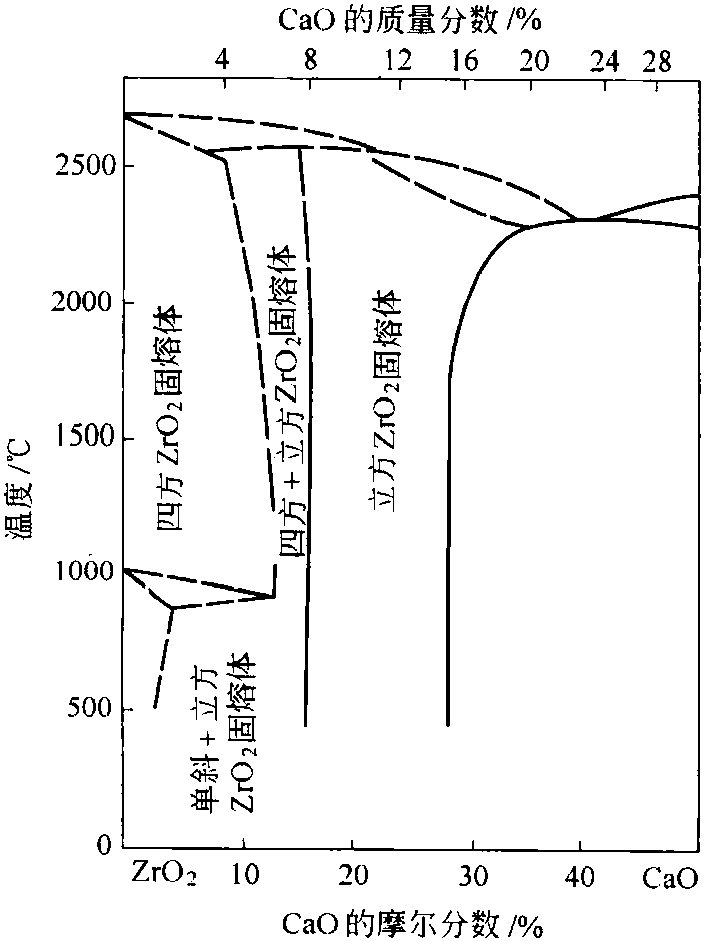
以CaO稳定的ZrO2,随CaO加入量的增加、稳定相也相应增加,但加入量在6%以上时已无明显的变化。
氧化钇是ZrO2最好的稳定剂。氧化钇的加入量以质量分数计算为8%~13%,以摩尔分数计算为7%~12%即可制得ZrO2-Y2O3的固熔体。在ZY系中Y2O3的含量和ZrO2的稳定度具有很大的相关性,当采用ZY-8时可基本达到稳定,但要达到全稳定要加入氧化钇13%。
【网络资料参考】
二氧化锆是锆的主要氧化物,通常状况下为白色无臭无味晶体,难溶于水、盐酸和稀硫酸。一般常含有少量的二氧化铪。化学性质不活泼,且高熔点、高电阻率、高折射率和低热膨胀系数的性质,使它成为重要的耐高温材料、陶瓷绝缘材料和陶瓷遮光剂。能带间隙大约为5-7eV。
【参考资料】
中国冶金百科全书总编辑委员会《有色金属冶金》卷编辑委员会,冶金工业出版社.
袁运开,顾明远 主编.科学技术社会辞典·化学.杭州:浙江教育出版社.
申泮文,王积涛 主编.化合物词典.上海:上海辞书出版社.2002.第14-15页.
http://www.chemicalbook.com/ProductChemicalPropertiesCB1495838.htm
http://baike.baidu.com/view/733776.htm
